Endocrinología y Nutrición
La especialidadArtículos especializados
Enfermedades
Síntomas
Otros contenidos

Enfermedad
Enfermedad de Addison
¿Qué es la enfermedad de Addison ?
La enfermedad de Addison es un trastorno que sucede cuando no se produce suficiente cantidad de hormonas en las glándulas suprarrenales . Suele haber un déficit de hormona cortisol y de aldosterona.
Tipos de insuficiencia suprarrenal
Existen algunas tipologías de este trastorno, que se pueden diferenciar en:
Insuficiencia Suprarrenal Primaria o Enfermedad de Addison: cuando se lesiona la corteza y no produce suficientes hormonas adrenocorticales. Suele ser una enfermedad autoinmune.
Insuficiencia Suprarrenal Secundaria: es la falta de producción de hormonas adrenocorticotrópica de la hipófisis. A veces se pone de manifiesto cuando se deja de tomar de repente un tratamiento a base de corticoesteroides.
Insuficiencia Suprarrenal Aguda o Crisis de Addison: la diferencia con la enfermedad de Addison radica en que los síntomas aparecen de forma repentina a consecuencia de una tensión física provocada por una enfermedad, lesión o infección, y puede llegar a provocar la muerte si no se trata a tiempo.
Causas de la enfermedad de Addison
La enfermedad de Addison es causada por una lesión en la corteza de las glándulas suprarrenales, ya sea originada por una enfermedad autoinmunitaria, un tumor, una infección o una hemorragia .
Síntomas de la enfermedad de Addison
Los síntomas de esta enfermedad se suelen desarrollar progresivamente, entre ellos destacan:
Disminución del apetito y pérdida de peso
Fatiga extrema
Náuseas, vómitos y diarreas
Hiperpigmentación u oscurecimiento de la piel
Presión arterial baja
Ganas de consumir sal
Hipoglucemia
Dolor de abdomen y muscular
Irritabilidad y depresión
Caída del vello
Pérdida de deseo sexual
Deshidratación
Fiebre baja
Tratamiento de la enfermedad de Addison
El tratamiento para los pacientes sintomáticos consiste en la toma de medicamentos orales de por vida, para el reemplazo de corticosteroides y mineralocorticoides para controlar los síntomas, corrigiendo los niveles de hormonas.
Si se entra en crisis suprarrenal, se debe inyectar hidrocortisona inmediatamente . Y, se suele necesitar tratamiento también para la baja presión arterial.
Se pautan, además, algunas recomendaciones, como aumentar el consumo de sal en la dieta, especialmente cuando se realice deporte o ejercicio intenso, en verano, si se padece diarrea, vómitos o algún trastorno gastrointestinal. A menudo, el médico puede corregir la dosis del tratamiento según si el paciente se encuentra afectado por alguna enfermedad menor, infección, cirugía, parto, etc.
El médico debe enseñar al paciente a auto-inyectarse corticosteroides, por si fuera necesario en situaciones de estrés. Es recomendable llevar siempre encima una pulsera identificativa de alerta médica y un kit de inyección.
Es recomendable, también, realizar meditación para aprender técnicas de reducción del estrés y evitar una crisis de Addison .
Pruebas complementarias de la enfermedad de Addison
Algunas de las pruebas complementarias que se pueden realizar incluyen:
Análisis de sangre, para detectar los niveles de hormonales y electrolitos.
Análisis de orina, para determinar la excreción de la hormona cortisol.
Pruebas por imágenes como radiografía abdominal o tomografía computarizada de abdomen para determinar el tamaño de la glándula.
Prueba de estimulación de ACTH (hormona adenocorticotropa), para medir el nivel de cortisol antes y después de la inyección de la hormona.
Prueba de hipoglucemia inducida por insulina, en caso de existir sospecha de ser un trastorno de la hipófisis.
Factores desencadenantes de la enfermedad de Addison
Se desconoce el verdadero desencadenante de esta enfermedad. Puede producirse por una destrucción de las glándulas suprarrenales debido a un cáncer u otra enfermedad , por el uso de algunos esteroides o medicamentos antifúngicos, o por una reacción autoinmune, entre otros.
Factores de riesgo de la enfermedad de Addison
Son factores de riesgo el estrés físico o padecer otra enfermedad como, por ejemplo, una infección, un traumatismo, una deshidratación, una situación emocional, etc .
Complicaciones de la enfermedad de Addison
Algunas complicaciones de la enfermedad de Addison pueden ser:
Diabetes
Anemia perniciosa
Tiroiditis crónica
Hipofunción ovárica o insuficiencia testicular
Hipertiroidismo
Y, si no se trata adecuadamente, puede producirse un shock hipotensivo, una insuficiencia respiratoria e, incluso, la muerte del paciente.
Prevención de la enfermedad de Addison
No hay forma de prevenir la enfermedad de Addison. No obstante, se recomienda realizar revisiones periódicas y, resulta conveniente prever situaciones que aumenten el estrés (como cirugías, lesiones, etc.) para intervenir de forma rápida, portar siempre un kit de inyección, y llevar una pulsera o cualquier identificación médica para poder recibir un tratamiento de emergencia en caso de necesitarlo.
Especialidades a las que pertenece
La especialidad médica a la que pertenece es la endocrinología, esta se encarga de estudiar el sistema endocrino y las enfermedades derivadas de un mal funcionamiento del mismo.
Preguntas frecuentes
¿Qué órganos afecta la enfermedad de Addison?
La enfermedad de Addison afecta a las glándulas suprarrenales, estos órganos pequeños se sitúan encima de los riñones y están formados por una corteza externa y la médula interna. Se encargan de secretar hormonas y, cuando no producen suficientes, sucede este trastorno denominado enfermedad de Addison.
¿Cómo se mide el cortisol?
El nivel de la hormona esteroidea cortisol (producida por la glándula suprarrenal) se mide a través de un análisis de sangre, también se puede hacer mediante un análisis de orina o de saliva.
Los resultados de laboratorio pueden variar, pero normalmente, unos valores normales de cortisol en adultos a las 8 am, sobre una muestra de sangre, suelen ser de 5 a 25 microgramos por decilitro o 140 a 690 nanomoles por litros. Un valor por encima de lo normal puede indicar alguna enfermedad como enfermedad de Cushing o tumor, y unos valores por debajo, enfermedad de Addison o hipopituitarismo, entre otras.
¿Qué es la aldosterona y para qué sirve?
La aldosterona es una hormona esteroidea y mineralocorticoide, producida por las glándulas suprarrenales, sirve para regular el metabolismo de los electrolitos, aumentando la presión en sangre, manteniendo sodio en el cuerpo y liberando potasio.
La enfermedad de Addison suele generar una disminución de aldosterona.
¿Qué hacen las glándulas suprarrenales?
La función principal de las glándulas suprarrenales es regular diferentes componentes del metabolismo y producir hormonas que son imprescindibles para la vida, como el cortisol o las hormonas sexuales.
¿Qué es la insuficiencia adrenal?
Una insuficiencia adrenal es un trastorno endocrino y hormonal causado por una producción insuficiente de hormonas suprarrenales, como cortisol o aldosterona.

Enfermedad
Hipotiroidismo en el Embarazo
¿Qué es el hipotiroidismo en el embarazo?
El hipotiroidismo en el embarazo es el descenso de la hormona tiroidea , que se produce por la alteración de la producción de la misma en el tiroides durante el embarazo. Esta situación puede favorecer los abortos, así como la eclampsia (hipertensión arterial en el embarazo), y puede producir en casos de hipotiroidismo severo, alteraciones en el desarrollo cerebral del niño. Obliga a que el control durante el embarazo sea más estricto, sobre todo en las mujeres cuyo hipotiroidismo fuera conocido previamente, ya que la demanda de hormona tiroidea es más alta durante la gestación.
Tipos de hipotiroidismo en el embarazo
Los tipos de hipotiroidismo no son diferentes en el embarazo que en las pacientes que no están embarazadas:
Hipotiroidismo primario: es la causa más frecuente de hipotiroidismo. En ella, se produce una falta de producción por alteración de la glándula tiroides. Es el caso de la tiroiditis de Hashimoto, causa más común de este proceso.
Hipotiroidismo secundario: es el que se produce por falta de hormona hipofisaria, conocida como TSH. Al no producirse en cantidad suficiente, no estimula tiroides y este no produce hormona tiroidea.
Hipotiroidismo terciario: hay falta de la hormona tirotropina que se produce en el hipotálamo, provocando una falta de producción de TSH y de T4.
Causas de hipotiroidismo en el embarazo
La causa del hipotiroidismo en el embarazo no difiere de las causas sin embarazo. La más frecuente es la enfermedad de Hashimoto , es una enfermedad autoinmune inflamatoria que daña la glándula tiroidea. Puede darse también en pacientes que presentan un hipotiroidismo congénito. En este caso se debe aportar la T4 desde la infancia, o en pacientes que han tenido poco aporte de yodo. En muchos casos es necesario dar un aporte de yodo suplementario en pacientes embarazadas, y también en aquellas que hayan tenido previamente una extirpación de tiroides por alguna causa.
Síntomas de hipotiroidismo en el embarazo
Los síntomas de hipotiroidismo en el embarazo son cansancio, dolor muscular, anemia por descenso de los glóbulos rojos, riesgo de insuficiencia cardíaca y como síntoma principal propio del embarazo, la preeclampsia, es decir, el aumento de la presión arterial durante el embarazo. Estos síntomas se dan en los hipotiroidismos severos, en los casos leves pueden no existir síntomas o ser achacables al propio embarazo .
Tratamiento de hipotiroidismo en el embarazo
El tratamiento del hipotiroidismo durante el embarazo es similar a todos los hipotiroidismos. Se realiza mediante la suplementación con hormona tiroidea . Se puede necesitar un aumento de entre el 25 y 50 % de las dosis previas, si la paciente ya estaba siendo tratada, debido a la mayor demanda de esta hormona durante el embarazo.
Pruebas complementarias del hipotiroidismo en el embarazo
La prueba complementaria es la analítica de sangre con determinación de TSH y hormona T4 que se realiza desde el inicio del embarazo. En los casos de hipotiroidismo previo, se hace analítica previa al embarazo y, cada 8 semanas, es necesario llevar a cabo un nuevo control analítico para reajustar la dosis en función de las diferentes necesidades de hormona durante el embarazo .
Puede ser necesaria la realización de una ecografía de la zona tiroidea para valorar el tiroides. No se realizan otras pruebas de imagen durante el embarazo.
Factores desencadenantes del hipotiroidismo en el embarazo
Los factores desencadenantes en el hipotiroidismo en el embarazo no difieren de los factores de riesgo sin el embarazo. En los casos de hipotiroidismo primario, la causa más frecuente será la enfermedad de Hashimoto, y la falta de yodo en el aporte alimenticio, por ello, en muchos casos, se da suplemento de yodo durante este estado.
En los casos de hipotiroidismo secundario, la causa más común es el adenoma hipofisario (tumor benigno en las células de la glándula hipófisis).
Los casos terciarios se dan por alteraciones a nivel del hipotálamo.
Factores de riesgo del hipotiroidismo en el embarazo
La falta de aporte de yodo es un factor de riesgo del hipotiroidismo en el embarazo .
Complicaciones del hipotiroidismo en el embarazo
Las complicaciones de hipotiroidismo en el embarazo son la dificultad para conseguir un embarazo en los casos mal controlados, la probabilidad de aborto en el primer trimestre, cuando la hormona no se encuentra en valores normales, y el riesgo de preeclampsia.
Prevención del hipotiroidismo en el embarazo
La prevención del hipotiroidismo durante el embarazo es la suplementación con yodo en aquellos casos que se crea necesario, y controles a lo largo del embarazo con tratamiento precoz y monitorizado de los hipotiroidismos que aparezcan.
Especialidades a las que pertenece
La especialidad a la que pertenece es la endocrinología, pero, si la paciente no tiene previamente hipotiroidismo, las analíticas con monitorizaciones hormonales son pedidas en primer lugar por obstetricia. El obstetra deriva al endocrino en los casos necesarios.
Preguntas frecuentes
¿ Qué significa TSH baja y t4 normal?
Cuando la TSH está baja y la T4 normal, indica una normalidad en la producción de hormona tiroidea, que puede haber estado precedida de una situación de hipertiroidismo. Por tanto, es necesario un nuevo control analítico pasado un periodo de unas 8 semanas, que permitan confirmar la normalidad en la producción de hormona tiroidea y descarten un hipertiroidismo.
¿Qué parte del cuerpo afecta el hipotiroidismo?
El hipotiroidismo afecta a múltiples órganos al ser una hormona reguladora. En primer lugar, puede afectar neurológicamente, produciendo estados depresivos y bradipsiquia. También, al sistema digestivo produciendo estreñimiento y dispepsia, o al muscular produciendo una astenia y falta de fuerza, al sistema de control de peso produciendo un aumento del mismo, defectos en control de la temperatura con una intolerancia al frío, la piel se altera y el pelo y las uñas se vuelven quebradizos y, puede haber enlentecimiento del pulso.
En casos muy extremos se puede llegar a sufrir un coma por esta causa.
¿Cuál es el nivel normal de prolactina en la mujer?
El nivel de prolactina puede variar a lo largo de la vida, siendo más alto durante la lactancia y en el embarazo. En situación normal, los niveles deben estar por debajo de 25 nanogramos por mililitro y, en caso de embarazo, pueden variar entre 80 y 400 nanogramos por mililitro .
¿Cuál es el especialista que trata el hipotiroidismo?
El especialista que diagnostica, controla y trata el hipotiroidismo es el endocrinólogo .
¿Cuál es el hipotiroidismo primario?
Se entiende por hipotiroidismo primario a la falta de producción de la hormona tiroidea originado en una alteración en la glándula tiroides , funcionando correctamente el eje hipotálamo-hipofisario.
Si quieres descubrir todos los consejos y cuidados que debe de tener una mujer embarazada, haz nuestro test sobre el embarazo .

Enfermedad
Obesidad Mórbida
¿Qué es la obesidad mórbida?
La obesidad mórbida es un exceso de peso de la persona en la que el índice de masa corporal o IMC se encuentra por encima de 40. Se define el IMC como el peso en kilogramos dividido por la altura en metros al cuadrado. La obesidad mórbida se considera la forma más extrema de obesidad.
Tipos de obesidad mórbida
Existen diferentes tipos de obesidad:
Obesidad mórbida grado 3 o de alto riesgo, con IMC igual o mayor a 40.
Obesidad mórbida grado 4 o extrema, con IMC por encima de 50.
Obesidad grado 1 y 2, no se considera obesidad mórbida, en el grado 1 el IMC se encuentra entre 30 y 34.9 y en el grado 2, de 35 a 39.9.
Causas de la obesidad mórbida
Aunque la causa principal de la obesidad mórbida se produce por un mayor consumo de calorías ingeridas frente a las calorías gastadas, son múltiples las causas que dan lugar a este proceso.
Causas genéticas: este es el caso de la enfermedad o síndrome de Prader Willi y el síndrome de Bardet Biedl, hay que tener en cuenta que hay asociación de obesidad familiar, hay familias de obesos. Esto hace pensar en una causa genética, pero también las familias comparten las mismas formas de comer, por lo que este factor también hay que tenerlo en cuenta.
Factores ambientales: como son el consumo de ciertos alimentos y la cantidad de ellos, así como la falta de ejercicio físico.
Problemas psicológicos de estrés, depresión o traumas: ya sea en la infancia o en la edad adulta, estos pueden colaborar en que la comida se establezca como una compensación.
Secundario a enfermedades endocrinas: como el síndrome de Cushing, el hipotiroidismo o el uso de esteroides, puede dar lugar también a aumento de peso.
Síntomas de la obesidad mórbida
El síntoma principal de la obesidad mórbida es el aumento excesivo de peso, que se traduce en una disminución de movilidad, en una alteración de las articulaciones, mayor riesgo de diabetes mellitus, de enfermedades cardiovasculares como hipertensión, cardiopatía isquémica e ictus y, también puede producir síndrome de apnea del sueño.
Otro problema asociado es el aislamiento social, que se produce por la falta de movilidad del paciente, pero también por el rechazo que un paciente siente por parte de la sociedad que le rodea, que considera que la obesidad se debe a una falta de interés del paciente por si mismo.
Tratamiento de la obesidad mórbida
El tratamiento de la obesidad mórbida lleva un conjunto de terapias para apoyar al paciente en la mejora de su situación.
En primer lugar es necesario indicar una dieta y unos buenos hábitos alimenticios, así como ejercicios que el paciente pueda realizar para ayudarle a mejorar de su situación.
Es preciso tratamiento psicológico y psiquiátrico de posibles alteraciones en esta esfera, como son la depresión y la ansiedad, además del apoyo psicológico necesario para mejorar los hábitos de vida del paciente.
Suele ser necesario recurrir a tratamiento quirúrgico de la obesidad mórbida, que se puede clasificar en tres tipos de cirugía: restrictiva, cirugía malabsortiva y cirugía de restricción y malabsorción combinadas.
Son cirugías restrictivas la banda gástrica, en la cual, se sitúa una banda de silicona para reducir el estómago, dando lugar a una saciedad más rápida.
Manga gástrica, en ella se procede a dar una forma de manga al estómago, dando lugar a un menor tamaño del mismo y creando una saciedad con una menor cantidad de alimento ingerido.
La cirugía malabsortiva o la derivación biliopancreática, en la cual se procede a disminuir el tamaño del estómago y a conectar este directamente con la segunda parte del intestino delgado, donde se secretan los jugos pancreáticos y biliares, evitando la absorción de alimentos en las zonas más próximas del intestino delgado.
El bypass gástrico con Y de Roux, se une el estómago con la parte más distal del intestino, es, por tanto, restrictiva y malabsortiva.
Pruebas complementarias de la obesidad mórbida
Las pruebas complementarias para lo obesidad mórbida son una analítica de sangre para conocer los niveles de azúcar, colesterol y el recuento celular del paciente, radiología de tórax, espirometría y estudio de apnea obstructiva del sueño.
El electrocardiograma permite conocer alteraciones cardiacas desconocidas hasta ese momento.
Por último, es necesario también, el estudio del sistema gastroduodenal por medio de endoscopia, para planear de forma adecuada la posibilidad de una cirugía bariátrica.
Factores desencadenantes de la obesidad mórbida
El factor desencadenante principal de la obesidad mórbida es el desequilibrio entre las calorías consumidas y las calorías gastadas por parte del paciente.
Factores de riesgo de la obesidad mórbida
Los factores de riesgo para la obesidad mórbida son la presencia de esta dolencia dentro del grupo familiar, en la cual parecen estar implicados factores genéticos asociados a alteraciones en el consumo de ciertos alimentos muy calóricos y a una disminución del ejercicio físico.
Complicaciones de la obesidad mórbida
Las complicaciones que lleva aparejada la obesidad mórbida son alteraciones cardiovasculares como hipertensión arterial, mayor riesgo de ictus y de infartos cardiacos, problemas respiratorios con disnea intensa y apnea del sueño, dolores articulares, mayor tasa de gota, alteraciones de la salud mental tipo depresión y ansiedad, y enfermedades endocrinológicas como la diabetes mellitus y litiasis biliar.
La mortalidad de este tipo de pacientes se presenta elevada respecto a lo que les corresponde por edad.
Prevención de la obesidad mórbida
La prevención de la obesidad mórbida se realiza con una alimentación equilibrada mediterránea, con consumo de frutas y verduras frescas, y hábitos de vida saludables con ejercicio diario que permite consumir parte de las calorías ingeridas.
No se deben consumir bebidas azucaradas, ni refrescos de forma habitual, tampoco bollería industrial, ni comida rápida.
Especialidades a las que pertenece
Los especialistas implicados en el tratamiento de la obesidad mórbida son varios; endocrinos y nutricionistas, psiquiatras, neurólogos y cirujanos generales son los más implicados en el tratamiento y el control de la obesidad mórbida. Es importante contar con una unidad de fisioterapia que establezca un régimen de ejercicio acorde al paciente.
Preguntas frecuentes
¿ Cuáles son los tipos de obesidad ?
Los tipos de obesidad se clasifican en diferentes grados, en función del índice de masa corporal:
grado 1, obesidad leve, IMC entre 30 y 34.9.
grado 2, obesidad moderada, IMC entre 35 y 39,9.
grado 3, obesidad mórbida, IMC por encima de 40.
grado 4, obesidad extrema, IMC por encima de 50.
El riesgo para los pacientes aumenta según aumenta el IMC. A mayor IMC, mayor riesgo para la salud del paciente.
¿ Cuáles son los riesgos de la obesidad grado 1 ?
La obesidad grado 1 aumenta el riesgo de padecer enfermedades endocrinológicas como la diabetes, elevación de los niveles de colesterol y triglicéridos, lo que puede derivar a un mayor riesgo cardiovascular y de sufrir dolores articulares. Dentro de la obesidad, es la que menor riesgo presenta, aunque esté elevada respecto a un paciente con normopeso.
¿ Cuándo se considera obesidad mórbida ?
La obesidad se considera obesidad mórbida cuando el IMC supera el nivel de 40, cuando supera el nivel de 50 se considera una obesidad extrema.
¿ Qué es androide y ginoide ?
Los términos androide y ginoide respecto a la obesidad marcan la zona donde de forma preferente se va a acumular la grasa.
La distribución androide es una distribución a nivel abdominal y de grasa visceral.
La distribución ginoide es la que se localiza principalmente en la zona de las piernas, glúteos y muslos.
La obesidad androide es la que presenta más riesgo de enfermedades cardiovasculares.
¿ Qué se puede hacer para evitar la obesidad infantil ?
Para evitar la obesidad infantil, es importante controlar los hábitos alimenticios de los niños, su alimentación debe de ser rica en frutas y verduras y pobre en grasas, evitando especialmente la bollería industrial.
Es importante también estimular la realización de ejercicio físico, controlando que no permanezcan sentados durante mucho tiempo.

Enfermedad
Pancreatitis
¿Qué es la pancreatitis?
La pancreatitis es un proceso inflamatorio de la glándula pancreática (páncreas), de gran tamaño. Se ubica detrás del estómago y se encarga de fabricar jugos digestivos o enzimas que ayudan a descomponer los alimentos en la parte superior del duodeno o intestino delgado. El páncreas también es el encargado de producir insulina y glucagón, dos hormonas que ayudan a controlar los niveles de azúcar en sangre y que constituyen la principal fuente de energía del organismo. La pancreatitis se desencadena por la activación inapropiada de las enzimas pancreáticas, resultado de una autodigestión del páncreas. La inflamación puede ser súbita (aguda) o progresiva (crónica). Es más frecuente en hombres que en mujeres y suele aparecer entre los 30 y los 60 años. Es una enfermedad grave. Los casos leves de pancreatitis pueden desaparecer sin tratamiento , pero los casos graves pueden causar complicaciones potencialmente mortales.
Tipos de pancreatitis
Existen dos tipos de pancreatitis:
Pancreatitis aguda : es un proceso inflamatorio agudo del páncreas con afectación variable de otros tejidos próximos y de órganos distantes, que se se produce generalmente por los cálculos biliares (piedras en la vesícula biliar) o a un consumo excesivo de alcohol, fenómenos que pueden provocar una autodigestión del páncreas por las enzimas que produce. Tiene pocos días de duración.
Pancreatitis crónica : es un proceso inflamatorio persistente (crónico) del parénquima y/o sistema ductal del páncreas, que tiene como consecuencia fibrosis y compromiso de sus funciones. Se debe generalmente a una repetición de la pancreatitis aguda. La ingesta prolongada y excesiva de alcohol también puede ser la causa de la pancreatitis crónica.
Causas de la pancreatitis
La pancreatitis tiene lugar cuando las enzimas digestivas se activan mientras están en el páncreas, lo que irrita las células del páncreas y provoca inflamación. Cuando el páncreas funciona normalmente, las enzimas que segrega no se vuelven activas hasta alcanzar el duodeno. Pero, cuando el páncreas está inflamado, las enzimas se activan precozmente (mientras todavía están dentro del páncreas) y empiezan a atacar sus estructuras internas. El tejido que recubre el interior del páncreas , encargado de fabricar enzimas, se lesiona debido a la actividad enzimática y, por lo tanto, deja de producir nuevas enzimas.
Las causas principales de la pancreatitis en más de un 80% de los casos están provocadas por cálculos (piedras) biliares inadvertidas y el abuso del alcohol. Otras causas menos frecuentes son la genética, los traumatismos, o el consumo de algunos medicamentos, drogas o toxinas. Otro motivo es cualquier tumor o inflamación que obstruya el conducto que drena el páncreas.
Síntomas de la pancreatitis
Los síntomas de la pancreatitis incluyen: dolor en la zona abdominal superior , dolor abdominal que se extiende a la espalda, taquicardia, dolor abdominal que empeora después de comer, náuseas, fiebre, dolor con la palpación al tocarse el abdomen, vómitos, pérdida de peso de forma involuntaria, sangrado pancreático, que se manifiesta en manchas cutáneas similares a moratones en los costados o cerca del ombligo y heces de aspecto aceitoso y mal olor.
Tratamiento para la pancreatitis
En los dos tipos de pancreatitis, no hay un tratamiento curativo . El de la pancreatitis aguda se enfoca en “dejar descansar” el páncreas mediante una dieta absoluta (no tomar nada) entre 2 y 4 días. Esto suele implicar la colocación de sonda nasogástrica y la administración de analgésicos intravenosos e hidratación por vena. En la pancreatitis crónica, el tratamiento es analgésico y se administran fármacos que ayuden a que las enzimas pancreáticas realicen adecuadamente su función. Hay que tener en cuenta que, en estos casos, con cada brote habrá más daños que irán limitando el funcionamiento del páncreas.
Pruebas complementarias del tratamiento de la pancreatitis
Para el diagnóstico y tratamiento de la pancreatitis es necesario realizar pruebas como: análisis de sangre para detectar niveles elevados de enzimas pancreáticas, tomografía computarizada para detectar cálculos biliares, ecografía abdominal para detectar cálculos biliares e inflamación del páncreas , o resonancia magnética para detectar anomalías en la vesícula, el páncreas y los conductos.
Factores desencadenantes de la pancreatitis
No se conoce un factor específico que pueda desencadenar este trastorno.
Factores de riesgo de la pancreatitis
Entre los factores que aumentan el riesgo de tener pancreatitis están: alcoholismo, cálculos biliares, ciertos medicamentos, fibrosis quística, antecedentes familiares de pancreatitis, niveles altos de calcio en la sangre, niveles altos de triglicéridos en la sangre , cáncer de páncreas, tabaquismo, sobrepeso y obesidad.
Complicaciones de la pancreatitis
Las complicaciones de la pancreatitis incluyen:
Pseudoquistes.
Insuficiencia renal .
Problemas respiratorios .
Diabetes.
Desnutrición.
Cáncer de páncreas .
Prevención de la pancreatitis
Para prevenir la pancreatitis es necesario:
Evitar el sobrepeso .
No tomar alcohol .
Evitar el consumo de tabaco .
Especialidades a las que pertenece la pancreatitis
La pancreatitis pertenece a la especialidad de gastroenterología. La gastroenterología es la parte de la medicina que se ocupa del estómago y los intestinos y sus enfermedades, así como del resto de los órganos del aparato digestivo.
Preguntas frecuentes
¿Cuál es la función del páncreas?
El páncreas es el encargado de fabricar jugos digestivos o enzimas, que ayudan a descomponer los alimentos en la parte superior del intestino delgado. El páncreas también es el encargado de producir insulina y glucagón, dos hormonas que ayudan a controlar los niveles de azúcar en sangre, la principal fuente de energía del organismo.
¿Por qué se inflama el bazo?
El bazo se puede inflamar debido a muchas enfermedades , como infecciones, enfermedad hepática y algunos tipos de cáncer que pueden causar un aumento de tamaño del bazo.
¿Cuál es la función del bazo?
El bazo forma parte del sistema linfático , que combate las infecciones y mantiene el equilibrio de los líquidos del cuerpo. Contiene los glóbulos blancos que luchan contra los gérmenes. El bazo también ayuda a controlar la cantidad de sangre del organismo y destruye las células envejecidas y dañadas.
¿Qué pasa si se rompe el bazo?
Al romperse el bazo se produce un sangrado de este órgano, con lo consiguiente se produce una hemorragia interna. En algunas ocasiones, en el momento del traumatismo puede no ocurrir una rotura completa del bazo, si no una laceración o una rotura pequeña que produzca un pequeño sangrado. Existen otras causas de rotura de bazo aparte del traumatismo; esto puede ocurrir en enfermedades que produzcan una inflamación importante del bazo, de manera que se rompa la membrana que lo rodea, y por consiguiente aparece su hemorragia.
Enfermedad
Osteopenia
¿Qué es la osteopenia?
La osteopenia es una disminución de la densidad mineral ósea por la que el hueso se vuelve más poroso, disminuyendo su masa, en la que todavía no se han presentado cambios definitivos en su estructura. La osteopenia es una alteración de diagnóstico densitométrico, es decir, se establece con la realización de una densitometría ósea al paciente, determinando con ello lo que es, según los resultados de esta prueba, la disminución de la densidad ósea comprendida entre 1 y 2.5 desviaciones estándar por debajo del valor de referencia de la población normal. Se puede considerar un paso previo a la osteoporosis, aunque no todo el mundo que presenta osteopenia va a desarrollar una osteoporosis en el futuro. Junto con la osteoporosis, la osteopenia es la enfermedad ósea más frecuente. Afecta en su mayoría a mujeres mayores de 50 años, aumentando su prevalencia según aumenta la edad. La osteopenia es una alteración de una gravedad leve-moderada, siendo un factor de riesgo que se suma a la osteoporosis, la edad, riesgo de caídas… etc, para el padecimiento de fracturas óseas.
Causas de la osteopenia
La osteopenia viene determinada por el pico máximo de masa ósea que cada individuo tiene y que se suele alcanzar a en torno a los 25-30 años. A partir de los 40 años la masa ósea va disminuyendo, habiendo un desbalance en los procesos de destrucción y producción de hueso que se producen durante toda la vida adulta, determinado por factores genéticos y la disminución de estrógenos en mujeres postmenopáusicas.
Síntomas de la osteopenia
La osteopenia en sí misma, como la osteoporosis, no produce síntomas claramente achacables a su padecimiento , salvo cuando se producen fracturas o microfracturas óseas.
Tratamiento para la osteopenia
El tratamiento de la osteopenia está basado en la indicación de realización de medidas generales como realizar ejercicio (andar, correr, nadar…) y administrar en la dieta un adecuado aporte de calcio y vitamina D. Cuando se determina analíticamente que existe déficit de estos dos componentes, el médico puede indicar un tratamiento específico según la carencia que se establezca de vitamina D y calcio en el paciente.
En principio, los fármacos que se utilizan para el tratamiento de la osteoporosis no están aprobados para su uso en el tratamiento de la osteopenia, reservándose a los casos de diagnóstico de osteoporosis asociados a un aumento real de riesgo de fracturas.
Pruebas complementarias del tratamiento de la osteopenia
Se puede realizar una analítica de sangre con determinación de calcio, fósforo y fosfatasa alcalina, entre otros.
La prueba complementaria de referencia para poder decir que un paciente tiene osteopenia es la densitometría ósea o DEXA ( Dual Energy X-Ray Absorptiometry ), prueba precisa que utiliza una mínima radiación y es un estudio rápido de realizar. Se establecen los valores en columna lumbar y cadera, de tal manera que se indica que existe osteopenia cuando los resultados de su índice “T-score” son entre -1.0 y -2.4, desviaciones estándar en comparación a una población de referencia con una densidad mineral ósea normal.
Factores de riesgo que pueden desencadenar la osteopenia
Los principales factores de riesgo para el desarrollo de la osteopenia son :
El déficit de estrógenos asociado a la menopausia.
La edad, a partir de los 50 años sobre todo. Cuanto mayor edad tenga el individuo, más riesgo existe de que este padezca osteopenia.
Antecedentes familiares de osteopenia, osteoporosis o fracturas óseas.
Toma de determinados fármacos como glucocorticoides sistémicos, heparina, anticonvulsivante…etc.
Padecimiento de enfermedades como hipogonadismo (testículos u ovarios no funcionales), hiperparatiroidismo, artritis reumatoide, síndrome de malabsorción, enfermedad celíaca…etc.
Alimentación deficiente y alteraciones alimentarias derivadas de patologías como anorexia o bulimia.
Complicaciones de la osteopenia
Desarrollo de osteoporosis.
Fracturas óseas, siendo más frecuentes en columna, cadera y antebrazo.
Desarrollo de alteraciones biomecánicas como pérdida de altura, deformidad en la columna, dorso-lumbalgias, etc.
Prevención de la osteopenia
Realización de ejercicio físico aeróbico como caminar a paso vivo, correr, montar en bicicleta o saltar, por ejemplo.
Garantizar una exposición solar diaria en manos, cara y brazos al menos durante 10-15 minutos al día, dos a tres veces por semana.
Evitar el consumo de tabaco.
Dieta variada y que contenga suficiente aporte de calcio (1gr/día en mujeres premenopáusicas; 1.2-1.5 gr/día durante el embarazo y la lactancia y 1.5 gr/día en mujeres postmenopáusicas).
Evitar tóxicos como el alcohol y un exceso de ingesta de café.
Especialidades a las que pertenece la osteopenia
La osteopenia puede ser valorada y diagnosticada por el médico de atención primaria, el médico reumatólogo y el traumatólogo . En ocasiones, en las revisiones ginecológicas de las paciente en edad postmenopáusica, el ginecólogo también valora realizar una densitometría para diagnosticar la influencia de este proceso fisiológico en los huesos.
Preguntas frecuentes
¿Qué debe comer una persona con osteopenia?
Es recomendable comer alimentos ricos en calcio como leche, quesos, yogures, yema de huevo, frutos secos, legumbres, espinacas, grelo, brócoli, acelga, cardo, col lombarda…etc. También alimentos que contengan vitamina D como el pescado azul (salmón, sardinas o caballa)
¿Qué es la osteopenia periarticular?
Es la pérdida de densidad mineral ósea producida alrededor de las articulaciones.
¿Cuál es el médico especialista en osteopenia?
El reumatólogo es el médico especialista en osteopenia y osteoporosis.
¿Qué diferencia hay entre la osteopenia y la osteoporosis?
La diferencia entre osteoporosis y osteopenia es la cuantía o importancia de la pérdida total de masa ósea del hueso. Así, se considera osteopenia la disminución de la densidad ósea comprendida entre 1 y 2.5 desviaciones estándar por debajo del valor de referencia de la población normal, y osteoporosis una densidad ósea inferior a 2.5 desviaciones estándar respecto al pico de masa ósea en adultos sanos.
¿Qué es el reuma?
El término reuma no es un término médico, es una denominación coloquial para referirse al conjunto de patologías que afectan al aparato locomotor.

Enfermedad
Intolerancia a la Lactosa
¿Qué es la intolerancia a la lactosa?
La intolerancia a la lactosa, intolerancia a la leche, deficiencia de lactasa, deficiencia de disacaridasa, o intolerancia a productos lácteos, es un trastorno en el que se produce una malabsorción del azúcar lactosa presente en la leche de los mamíferos , debido a una alteración en el intestino que provoca un déficit de la enzima que digiere este azúcar, la lactasa. Es una patología muy común, cuya frecuencia varía según la etnia de la población y la latitud en la que geográficamente se localiza. En España, un tercio de la población padece esta malabsorción. Es un trastorno que no suele comprometer la vida del paciente, aunque puede producir hasta su diagnóstico molestias abdominales y trastornos intestinales importantes e implica una limitación en cuanto a los alimentos que el paciente puede ingerir.
Tipos y causas de intolerancias a la lactosa
Según el orígen del inicio de la intolerancia, del tipo de déficit de lactasa se clasifica en:
Primaria : (hipolactasia del adulto) tiene carácter hereditario, que da síntomas en el adolescente o adulto joven. El déficit de lactasa en este caso raramente es del 100% y el paciente puede tolerar pequeñas cantidades de lactosa sin producir síntomas.
Secundaria o adquirida : puede producirse un déficit transitorio de lactasa en un intestino que habitualmente no tiene ninguna alteración. Durante un episodio agudo de una gastroenteritis infecciosa, se produce un daño en la mucosa (revestimiento del intestino), que hace desaparecer la enzima. También puede ser producida por la toma de medicamentos como la Aspirina , antiinflamatorios no esteroideos, antibióticos…etc. Asimismo, enfermedades crónicas del intestino delgado también pueden producir la reserva intestinal enzimática de lactasa, como la fibrosis quística, el síndrome de Zollinger Ellison, enteritis por virus de la inmunodeficiencia humana… etc.
Congénita (alactasia) : tipo muy raro de déficit de lactasa. Los síntomas se presentan desde el nacimiento cuando el bebé ingiere leche.
Síntomas de la intolerancia a la lactosa
Los síntomas más frecuentes son dolor abdominal, diarrea, hinchazón abdominal, flatulencia y vómitos tras la ingestión de alimentos que contengan este tipo de azúcar. En casos severos puede aparecer deshidratación y desnutrición.
Tratamiento para la intolerancia a la lactosa
El tratamiento se basa en la eliminación de la dieta del aporte de lactosa y, con ello, de todos los alimentos que la contengan. Hay pacientes que no tienen un déficit de la enzima que hidroliza este azúcar del 100%, por lo que en estos casos está indicado disminuir el consumo de lactosa a los niveles que puedan tolerar sin producción de síntomas, de hecho, este término es la opción más recomendada por los médicos. Si es preciso se complementará la dieta con suplementos nutricionales para asegurar el aporte de sustancias fundamentales para el organismo como el calcio y la vitamina D. Los pacientes con toma de tratamientos farmacológicos crónicos que tengan una intolerancia total, también tienen que vigilar la presencia de lactosa como excipiente de los fármacos que toman.
Pruebas complementarias del tratamiento de la intolerancia a la lactosa
Junto con el interrogatorio clínico sobre los síntomas que presenta el paciente y la exploración física, se pueden realizar los siguientes tests para confirmar el diagnóstico:
Test de tolerancia a la lactosa : se realiza una sobrecarga de 50 gramos de lactasa y se hacen controles de la glucosa en sangre a los 30 minutos durante las siguientes dos horas después de la ingesta. Si el nivel de glucosa en sangre no aumenta al menos 20 miligramos del nivel basal, se considera que puede haber un déficit de lactasa. Tiene el inconveniente de que la prueba se puede ver alterada por patologías como la diabetes mellitus, entre otras.
El test del hidrógeno espirado : se basa en la detección del hidrógeno que expira el paciente tras ingerir 50 gramos de lactosa, ya que al no poderse absorber en el intestino delgado, la lactasa pasa al intestino grueso en su gran mayoría y allí, las bacterias del intestino producen una degradación de la lactosa con aumento del hidrógeno que se absorbe en el colon y posteriormente se elimina con la respiración.
Determinación del pH de las heces : cuando existe una alteración en la absorción de lactosa, aumenta el ácido láctico en las heces, presentando éstas un PH ácido que se detecta para hacer el diagnóstico
Estudio genético : para clasificar a los pacientes como “lactasa-deficientes” o “lactasa-persistentes”
Por último, se puede realizar la toma de un pequeña muestra de tejido de la mucosa del intestino delgado para analizarlo y determinar la ausencia de lactasa.
Factores desencadenantes de la intolerancia a la lactosa
La intolerancia a la lactosa es debida a una malabsorción de la misma, la cual está desencadenada por la producción insuficiente de lactasa (hipolactasia), en el intestino delgado, enzima que divide a la lactosa en dos azúcares más pequeños que son los absorbidos por el cuerpo.
Factores de riesgo de la intolerancia a la lactosa
Bebés prematuros.
Ser de origen asiático, africano, nativos americanos y mediterráneos.
Padecer enfermedades infecciosas intestinales.
Padecer enfermedades digestivas crónicas como la celiaquía.
Complicaciones de la intolerancia a la lactosa
Diarrea severa.
Deshidratación.
Desnutrición.
Déficit de elementos como el calcio cuando se restringe el aporte de leche en la dieta sin suplementos añadidos, lo que puede derivar en otras complicaciones como aparición de osteoporosis, entre otras.
Prevención de la intolerancia a la lactosa
No existe una manera eficaz de prevenir la intolerancia a la lactosa.
Sí se pueden evitar los síntomas y complicaciones que de ello deriva, restringiendo en la dieta los alimentos que más lactosa contienen.
Especialidades a las que pertenece la intolerancia a la lactosa
Esta patología es diagnosticada y tratada por los especialistas en aparato digestivo.
Preguntas frecuentes:
¿Cuáles son los alimentos que contienen lactosa?
La lactosa es un azúcar que está presente en todas las leches de los mamíferos : vacas, cabras, ovejas y en la leche humana. Existen múltiples alimentos procesados y preparados en el mercado que pueden contener lactosa, como galletas, caldos, panes, embutidos…etc.
¿Qué quiere decir “sin lactosa”?
Esa especificación que habitualmente viene detallada en algunos alimentos, hace referencia a que han eliminado de ellos el azúcar lactosa.
¿Qué produce la lactosa?
La lactosa es un tipo de azúcar presente de manera natural en la leche y los productos lácteos.
¿Cuál es la principal función de la lactosa?
La lactosa es un azúcar, el principal azúcar de la leche de los mamíferos. Cuando se ingiere es transformada en el intestino por una enzima en dos azúcares más sencillos, la glucosa y la galactosa que son absorbidos por el cuerpo. Su función, como la de cualquier azúcar, es aportar energía al organismo . Además, la galactosa desempeña varias funciones biológicas y participa en los procesos inmunitarios y neuronales. Por otro lado, la lactosa y otros azúcares de la leche también favorecen el crecimiento de bacterias en el intestino que forman la microflora intestinal . Se cree además que a lactosa podría influir en la absorción del calcio y otros minerales, como cobre y zinc, sobre todo durante la etapa de lactancia.
¿Qué es la lactasa?
La lactasa es una enzima intestinal cuya función es desdoblar la lactasa en glucosa y galactosa, dos azúcares más sencillos y más fáciles de absorber en el intestino.

Enfermedad
Diabetes Insípida
¿Qué es la diabetes insípida?
La diabetes insípida es una enfermedad poco frecuente, en la cual los riñones no pueden evitar la eliminación del agua a través de ellos . Es una enfermedad rara, que se produce en un caso de cada 25.000 personas y que suele presentarse en la segunda década de la vida. Es una enfermedad grave que puede provocar cuadros de deshidratación importantes.
Tipos de diabetes
Los tipos de diabetes son:
Diabetes mellitus : es la enfermedad que se produce por alteraciones en el nivel de glucosa, dentro de este tipo de diabetes tenemos:
Diabetes mellitus tipo I : que se produce en la infancia o adolescencia y precisa de aporte de insulina.
Diabetes mellitus tipo II : que se da en adultos y se puede controlar durante mucho tiempo con antidiabéticos orales.
Diabetes insípida : que puede ser:
Central : cuando el origen está en la falta de producción de Vasopresina por parte de hipotálamo.
Nefrógena : se da cuando el riñón no responde de modo adecuado a la hormona Vasopresina .
Causas de la diabetes insípida
La diabetes insípida central tiene diferentes causas que pueden ser genéticas: traumatismos craneales, infecciones, enfermedades autoinmunes, tumores de hipófisis, alteración en el riesgo de la hipófisis.
La diabetes insípida renal tiene un origen genético, ciertos fármacos como el litio, hipercalcemia o poliquistosis renal.
Síntomas de la diabetes insípida
Los síntomas de la diabetes insípida serán la sed excesiva que hará beber sin parar, y la producción de orina de forma constante , que dará lugar a emisión de orina también de modo constante.
Tratamiento de la diabetes insípida
La diabetes insípida de origen central se va a corregir suministrando Vasopresina , en forma inyectable, por vía oral o por vía nasal.
Si la diabetes insípida de origen nefrógena está causada por fármacos, se va a proceder a retirar el fármaco causante, y tratar el exceso de calcio con adecuada ingesta de líquido para evitar la deshidratación. También pueden administrarse medicamentos que disminuyan la diuresis.
Pruebas complementarias de la diabetes insípida
Las pruebas complementarias que se realizan son:
Analítica de sangre : para buscar la cantidad de sodio presente. Se realizará también el control de orina, para valorar osmolaridad, concentración y cantidad de sodio excretado, y la medición de la diuresis en 24 horas.
Prueba de provocación con Vasopresina : para tratar de diferenciar si el origen es central oneforgeno.
Resonancia magnética cerebral : que va a permitir conocer cómo está la hipófisis.
Factores desencadenantes de la diabetes insípida
El factor desencadenante en la diabetes insípida central es la falta de vasopresina.
El factor desencadenante de la diabetes insípida nefrógena es la falta de respuesta a la Vasopresina del riñón.
Factores de riesgo de la diabetes insípida
Son factores de riesgo para la diabetes insípida la presencia de dicha enfermedad en la familia, el consumo de litio, la hipercalcemia y la poliquistosis renal .
Complicaciones de la diabetes insípida
Las complicaciones de la diabetes insípida son:
Deshidratación.
Alteración de los electrolitos sanguíneos.
Prevención de la diabetes insípida
La diabetes insípida central no se puede prevenir.
La diabetes insípida nefrógena se puede prevenir controlando el uso de fármacos como el litio y control de la hipercalcemia.
Especialidades a las que pertenece
La diabetes insípida se controla por un equipo multidisciplinar de neurólogos, neurocirujanos, endocrinos y nefrólogos, dependiendo de su origen. Si es central, participan más los neurólogos y endocrinos, y si es renal, la participación será mayor por parte de los nefrólogos.
Preguntas frecuentes:
¿Qué significa dipsogénico?
El significado de dipsogeno es que produce sed . La angiotensina que se produce en el eje renal renina-angiotensina está involucrada en el proceso de la sed.
¿Cómo actúa la hormona ADH?
La ADH u hormona antidiurética es la hormona que se libera en relación con los cambios de osmolaridad o de volumen sanguíneo. En el riñón va a actuar dando lugar a una concentración de la orina, con reducción de su volumen, estimulando la reabsorción del agua. La hormona también funciona a nivel cerebral y de los vasos sanguíneos. Su función a nivel renal va a dar lugar a un aumento de volumen sanguíneo, disminuyendo la osmolaridad sanguínea. En los vasos sanguíneos se da lugar a un aumento del retorno venoso y del gasto cardíaco. En las situaciones de deshidratación, esta hormona va a ser secretada dando lugar a una disminución de la pérdida de agua, y por tanto mejorará la deshidratación.
¿Cuál es el órgano que procesa el azúcar?
No podemos hablar de un órgano que procese el azúcar, ya que todas las células de nuestro organismo necesitan el azúcar para su supervivencia. Si de lo que hablamos es del control de nivel de azúcar en sangre, dos son los órganos más implicados en este proceso. Así, tenemos el páncreas, que al producir insulina dará lugar a una correcta regulación de los niveles de azúcar en sangre, y el hígado , lugar donde el azúcar es transformado en glucógeno de esta forma queda almacenado pudiéndose quemar en caso necesario de falta de azúcar.
¿Qué es la insulina?
La insulina es una hormona que se produce en el páncreas y se encarga de la regulación del azúcar en la sangre a nivel celular , permitiendo que la glucosa se introduzca dentro de las células, para ser usadas por estas en la producción de energía.
¿Dónde se produce exactamente la insulina en el cuerpo?
La insulina se produce en el páncreas, este órgano se encuentra en el abdomen, en la parte alta del mismo, tras el estómago, y se encuentra conectado mediante un conducto sobre el duodeno.

Enfermedad
Intoxicación Alimentaria
¿Qué es una intoxicación alimentaria?
Una intoxicación alimentaria es una infección causada por microorganismos (bacterias, virus o parásitos), que entran en nuestro organismo a través de comida que ingerimos. También puede producirse una intoxicación por otras sustancias dañinas, como aditivos, hormonas…etc, presentes en los alimentos. Es una alteración común que puede aparecer en cualquier persona, ya sea adulta y niña, y a cualquier edad. Aunque en muchas ocasiones son alteraciones leves y autolimitadas , también se pueden dar casos de gravedad que pongan en serio peligro la vida del paciente.
Tipos de intoxicaciones alimentarias
Intoxicaciones por agentes infecciosos : se producen por virus, bacterias o sus toxinas y parásitos.
Intoxicaciones por otros agentes químicos y metales .
Causas de una intoxicación alimentaria
Se han descrito más de 250 agentes diferentes que pueden producir una intoxicación alimentaria. Entre estos destacan las intoxicaciones por bacterias como la Salmonella, Listeria monocytogenes, Escherichia coli, Clostridium perfringens, Yersinia enterocolitica, Vibrio cholera e…etc. También existen virus que pueden producir una intoxicación, como el virus de la hepatitis A, virus del género Norovirus , parásitos como el Anisakis o protozoos como la Cyclospora cayetanensis .
Existen otro tipo de agentes que causan una intoxicación alimentaria si están presentes en alimentos ingeridos como sustancias químicas, metales, hormonas…etc.
Síntomas de una intoxicación alimentaria
Pueden variar según el agente infeccioso que produce la intoxicación, pero, en general, producen síntomas como náuseas, vómitos, diarrea , que puede ser abundante y acuosa, con mucosidad o sangre. Puede existir fiebre, dolor abdominal, cansancio y fatiga. En caso de intoxicación por Clostridium pueden aparecer síntomas neurológicos
Tratamiento para la intoxicación alimentaria
De forma habitual se pauta un tratamiento de base para la reposición de agua y electrolitos con administración de suero oral o, si los síntomas son muy intensos y persistentes, administración de sueros intravenosos . Habitualmente se indica mantener una dieta absoluta excepto el aporte del suero durante las primeras 12-24 horas para iniciar posteriormente una dieta blanda astringente. Además, se pautan analgésicos como Paracetamol para el control del dolor y la fiebre, antiácidos para proteger la mucosa gástrica, o antiheméticos para disminuir las vómitos y náuseas. En ocasiones se pautan antibióticos para combatir determinados tipos de infecciones bacterianas. Además, se pueden tratar complicaciones o formas específicas de respuesta del organismo.
Pruebas complementarias del tratamiento de una intoxicación alimentaria
A parte de la exploración física con toma de constantes como la tensión arterial, el pulso, la frecuencia respiratoria y la temperatura, y además de la entrevista clínica para ayuda del diagnóstico y la búsqueda del orígen, se suele realizar pruebas complementarias como:
Coprocultivo : con estudio microbiológico de las heces en búsqueda de la posible bacteria que puede producir la intoxicación.
Examen microscópico en fresco de las heces : con tinciones específicas que ayudan a encontrar los microorganismos.
Identificación de toxinas : de los microorganismos en heces o vómitos.
Analítica de orina .
Analítica de sangre .
Pruebas de imagen : como radiografía de abdomen o TAC abdominal.
Factores desencadenantes de una intoxicación alimentaria
El factor desencadenante es la ingestión de un alimento tanto sólido como líquido, que esté contaminado por sustancias orgánicas o inorgánicas y que sean potencialmente perjudiciales para el organismo.
Factores de riesgo de una intoxicación alimentaria
Mujeres embarazadas.
Edad: es más frecuente en niños y ancianos.
Pacientes con inmunodeficiencia (defensas bajas).
Manipulación, preparación o conservación inadecuadas de los alimentos.
Complicaciones de una intoxicación alimentaria
Deshidratación.
Insuficiencia renal por deshidratación.
Hipotensión.
Síndrome hemolítico urémico.
Parálisis muscular.
Alteraciones en fetales y abortos en embarazadas.
Artritis reactiva.
Muerte.
Prevención de la intoxicación alimentaria
Evitar comer carnes, pescados, huevos o mariscos poco cocinados y/o crudos.
Leche y derivados sin pasteurizar.
Cocinar en adecuadas condiciones higiénicas: lavado de manos así como limpieza de la cocina y sus utensilios.
Cocinar a óptimas temperaturas los alimentos.
Refrigerar los alimentos adecuadamente manteniendo la temperatura del frigorífico y la cadena de frío. Meter la comida ya cocinada en torno a las dos horas posteriores de su finalización.
Control veterinario según la legislación vigente de los animales de consumo.
Lavado de manos frecuente, sobre todo antes y después de ir al baño y antes de cocinar o manipular alimentos
Especialidades a las que pertenece la intoxicación alimentaria
La intoxicación alimentaria puede diagnosticarse y tratarse por el médico de atención primaria, por los especialistas de los servicios de urgencias hospitalarias, médicos internistas, y los especialistas en aparato digestivo o en enfermedades infecciosas.
Preguntas frecuentes:
¿Cuál es la intoxicación alimentaria más frecuente?
En la época invernal es frecuente que haya picos de infecciones víricas y, en verano y principios de otoño, es frecuente la aparición de brotes provocados por bacterias, sobre todo por salmonelosis o por infección de Escherichia coli ( E coli ).
¿Qué es la salmonelosis?
La salmonelosis gastrointestinal es una de las enfermedades de transmisión alimentaria más frecuente , producida por una bacteria ( Enterobacteria ), que se adquiere por ingestión de comida o bebida contaminada por vía oral, o por contacto con animales o mascotas infectados por la bacteria o por transmisión de persona a persona (oro-fecal).
¿Cuál es la intoxicación alimentaria más peligrosa?
Aunque casi todas las intoxicaciones alimentarias pueden desarrollar complicaciones graves que pongan en peligro la vida del paciente, sobre todo en aquellos con patologías de base de gravedad, la toxiinfección por Clostridium con afectación neurológica importante puede considerarse de las intoxicaciones alimentarias más graves.
¿Qué es el anisakis?
El Anisakis o Anisakiasis es una enfermedad parasitaria causada por la ingesta de pescado crudo que contenga las larvas de un parásito llamado Anisakis simplex. se produce cuando se ingieren especies de peces o mamíferos marinos infectados, crudos o poco cocidos, contaminadas por el gusano Anisakis simplex, que parasita la pared gástrica y puede producir en el hombre una infección gastrointestinal o reacciones alérgicas .
¿Qué es la intoxicación botulínica?
Es la toxiinfección alimentaria producida por ingesta de una comida infectada por la toxina producida por la bacteria Clostridium Botulinum . Habitualmente por consumo de conservas en mal estado y en algunos casos por marisco contaminado, también en salazones y ahumados.

Enfermedad
Deshidratación
¿Qué es la deshidratación?
La deshidratación es la pérdida excesiva de agua o líquidos del organismo . Cuando se pierde más agua que la que se ingiere, el cuerpo no puede funcionar en condiciones normales. Es un cuadro clínico más frecuente en niños y ancianos, y también se suele originar cuando se padece alguna enfermedad que provoca vómitos constantes o diarreas. La deshidratación leve es bastante común y suele ser provocada por la ingesta insuficiente de líquidos, no obstante, pueden darse casos graves de deshidratación en los que la pérdida equivalga a más del 10% del peso corporal y se produzcan complicaciones mayores.
Tipos de deshidratación
Existen diferentes tipos de deshidratación:
Deshidratación isotónica : la pérdida de agua equivale a la de solutos (sales, iones y resto de componentes que circulan con el agua). Suele ser la más frecuente y ocurre, a menudo, cuando se sufre gastroenteritis.
Deshidratación hipertónica : se pierde más agua que sales o electrolitos, provocando la elevación de los niveles de sodio en sangre.
Deshidratación hipotónica : se pierden proporcionalmente más solutos que agua y deriva en una mínima concentración de sodio en sangre. Es la menos común.
Causas de la deshidratación
Las causas más comunes de la deshidratación son: no beber suficiente agua o líquidos al día, padecer diarrea o vómitos agudos, fiebre, sudoración excesiva , exceso de orina, quemaduras solares, algunos medicamentos como los diuréticos, enfermedades como la diabetes insípida, o ciertas enfermedades renales.
Síntomas de la deshidratación
Cuando la deshidratación es leve, sus síntomas más habituales son: sed, boca seca, orina oscura, piel seca, pérdida de apetito, dolor de cabeza, malestar y calambres musculares. Si la deshidratación es más grave se considera una emergencia médica, ya que puede dejarse de orinar, originarse confusión, sentir mareos, falta de coordinación, fatiga, taquicardia, enturbiamiento de la visión, apatía, incluso sufrir delirio e inconsciencia y, en los casos más extremos y sin tratamiento, la muerte.
Tratamiento de la deshidratación
El tratamiento de la deshidratación consiste en beber agua a pequeños sorbitos o chupar un hielo e ingerir bebidas que contengan electrolitos , para así recuperar los líquidos y sales perdidas. En niños pequeños o lactantes se ofrece una solución oral que contiene agua y electrolitos que puede administrarse con una jeringuilla, pero también se puede enmascarar el agua mezclándola con zumos para darle sabor.
En los casos más graves, se requiere la hospitalización para suministrar líquidos por vía intravenosa y controlar la evolución del paciente.
Pruebas complementarias de la deshidratación
Normalmente, el médico diagnostica la deshidratación al observar los síntomas , pero puede ayudarse de algunas pruebas complementarias como son medir la presión sanguínea y la frecuencia cardíaca y realizar pruebas de laboratorio para confirmar el diagnóstico. Estas otras pruebas pueden consistir en realizar un análisis de sangre para verificar los niveles de electrolitos (como el sodio y el potasio) y comprobar el funcionamiento renal, o un análisis de orina para detectar cistitis (infección urinaria) y comprobar el grado de deshidratación presentado.
Factores desencadenantes de la deshidratación
Los factores desencadenantes de la deshidratación son: las temperaturas altas, la realización de deporte intenso, no beber la cantidad suficiente de agua , el consumo de algunos medicamentos y sufrir alguna enfermedad como puede ser una gastroenteritis.
Factores de riesgo de la deshidratación
Los lactantes y niños, ancianos, embarazadas y deportistas , son grupos de riesgo que necesitan un cuidado especial del suministro regular de agua. Personas que padecen diabetes, alcoholismo, u otras enfermedades crónicas del riñón, también presentan mayor propensión. Trabajar en ambientes húmedos y muy calurosos, de igual forma, contribuye a padecer deshidratación.
Complicaciones de la deshidratación
Según la gravedad de la deshidratación, se pueden presentar diferentes complicaciones:
Golpe de calor.
Calambres musculares.
Agotamiento.
Infección en el tracto urinario y fallo renal.
Afectación de las funciones cognitivas como la coordinación.
Convulsiones.
Pérdida de conciencia.
Daño cerebral.
Choque hipovolémico (disminución de la presión arterial y de la cantidad de oxígeno).
Fallecimiento.
Prevención de la deshidratación
Para prevenir la deshidratación resulta imprescindible:
Beber suficiente agua y líquidos a diario (al menos 8 vasos de agua al día ).
Beber a menudo, aunque no se tenga sed.
Consumir alimentos ricos en agua, como las frutas y verduras.
Aumentar la ingesta de agua y líquidos con electrolitos si se está enfermo, se padecen vómitos y/o diarrea, o si se realiza ejercicio intenso o hace mucho calor.
Evitar consumir bebidas con cafeína, teína o alcohol en climas muy calurosos, ya que son diuréticos y contribuyen a la pérdida de agua y electrolitos.
Especialidades a las que pertenece
El problema de deshidratación lo trata inicialmente la especialidad de medicina interna y la de medicina de familia. En caso de complicaciones pueden intervenir especialistas en medicina intensiva, endocrinología y digestivo.
Preguntas frecuentes:
¿Qué tomar para la deshidratación?
Cuando se padece una deshidratación se debe beber agua a sorbos o chupar cubitos de hielo. También conviene ingerir líquidos con electrolitos y tomar alimentos ricos en agua como la lechuga, la coliflor, el tomate, la sandía, el melón…etc.
¿Qué es la deshidratación hipertónica?
La deshidratación hipertónica se da cuando la pérdida de agua es superior a la de sales minerales.
¿Cuáles son las consecuencias de la deshidratación?
La consecuencia principal de la deshidratación es el cambio de color mostrado en la orina, (esta se hace más oscura). También disminuye la producción de saliva, favoreciendo infecciones bucales. La mala hidratación puede tener consecuencias perjudiciales para la salud y provocar, además; sed, mareos, cansancio, dolor de cabeza, infecciones urinarias, calambres musculares y afectar al rendimiento físico y mental, entre otros.
¿Qué es la deshidratación hipotónica?
La deshidratación hipotónica se da cuando la pérdida de sales minerales o electrolitos es superior a la de agua.
¿Cómo es el dolor de cabeza por deshidratación?
La deshidratación provoca una disminución del volumen de sangre, afectando a la cantidad de sangre rica en oxígeno que llega al cerebro y provocando contracciones de los vasos sanguíneos del cerebro, lo que puede originar dolores de cabeza tensionales intensos, migrañas y dificultad de concentración.

Enfermedad
Anorexia Nerviosa
¿Qué es la anorexia nerviosa?
La anorexia nerviosa o, anorexia, como se la denomina comúnmente, es un trastorno de desorden alimentario cuya principal característica recae en tener un peso extremadamente bajo (por debajo de lo que se considera saludable), a consecuencia de la propia restricción alimentaria del individuo por miedo a engordar. La persona anoréxica tiene una percepción distorsionada de su peso y su cuerpo, lo que la lleva a evitar el aumento de peso, ingiriendo menos cantidad de comida, provocando el vómito después de comer, o tomando laxantes o diuréticos. La anorexia es una enfermedad común grave que, aunque puede presentarse a cualquier edad, es más frecuente en mujeres adolescentes de clase social media y media-alta, también es común en bailarinas, gimnastas y modelos.
Tipos de anorexia
Existen dos tipos distintos de anorexia:
Tipo restrictivo : es una anorexia o bajada drástica de peso ocasionada por la restricción de comidas y la realización intensa de ejercicio.
Tipo bulímico : también denominado purgativo o compulsivo. La reducción de peso se consigue provocando vómitos o ingiriendo laxantes después de darse atracones de comida.
Causas de la anorexia nerviosa
La anorexia nerviosa puede desencadenarse por la combinación de diferentes factores genéticos, psicológicos y socioculturales como:
Depresión.
Ansiedad.
Obesidad.
Pérdidas afectivas.
Trastorno obsesivo compulsivo.
Insatisfacción personal o corporal.
Sucesos traumáticos.
Sentimiento de perfeccionismo.
Antecedentes familiares.
Cultura del país con respecto a los patrones de belleza.
Presión por parte de grupos sociales.
Síntomas de la anorexia nerviosa
Los síntomas de la anorexia a menudo pueden pasar desapercibidos durante bastante tiempo porque el propio enfermo los trate de ocultar.
Algunos síntomas físicos presentados son: delgadez extrema, cansancio, mareos, desmayos, ausencia de menstruación, piel seca, dolor de abdomen , presión arterial baja, deshidratación, sensación de frío constante, callosidades en los nudillos por la provocación de los vómitos, anemia, estreñimiento, caída del cabello, problemas dentales y arritmias, entre otros.
En cuanto a los síntomas emocionales y de conducta, puede presentarse un régimen estricto o saltarse las comidas poniendo excusas, preocupación por los alimentos, sobre todo los de alta carga calórica, mentir acerca de la comida, acudir al baño siempre inmediatamente después de comer para provocar los vómitos, miedo a engordar, quejarse del aspecto y peso, distorsión de la imagen corporal , irritabilidad, tristeza , falta de apetito sexual, vestirse con muchas capas de ropa, mirarse continuamente al espejo, aislamiento social, baja autoestima…etc.
Tratamiento de la anorexia nerviosa
El tratamiento más urgente de la anorexia nerviosa es la r ealimentación para intentar alcanzar cuanto antes un aumento del peso (es posible que se necesite una sonda nasogástrica para recibir los alimentos). Educación nutricional para volver a coger buenos hábitos alimenticios y tratar de recuperar la normalidad biológica en los indicadores sanguíneos y regreso de la menstruación.
Posteriormente, se tratan de resolver los problemas psicológicos con un psicoterapeuta o grupo de apoyo. Es un proceso largo, ya que primero hay que hacer entender al paciente que tiene una enfermedad y luego proceder a mejorar su autoestima y el resto de problemas psíquicos que se presenten.
Si la desnutrición o los desórdenes psíquicos son graves, se debe hospitalizar al paciente para controlar los signos vitales, la deshidratación y otras afecciones, aunque el tratamiento continúe después en el domicilio.
También pueden prescribirse algunos medicamentos antidepresivos como parte de ayuda complementaria al tratamiento.
Pruebas complementarias de la anorexia nerviosa
Algunas pruebas son determinantes para el diagnóstico y ayudan a determinar si existen otras complicaciones derivadas de la anorexia:
Análisis de sangre con hemograma completo: para hacer un recuento de la células sanguíneas, medir la cantidad de albúmina y electrolitos, y comprobar la función hepática, renal y tiroidea.
Análisis de orina.
Evaluación psicológica.
Radiografías o pruebas de densidad ósea.
Electrocardiografía.
Factores desencadenantes de la anorexia nerviosa
Algunos de los factores que pueden desencadenar la anorexia nerviosa son el exaltamiento de la delgadez en la mujer que promueve l a cultura occidental y la presión de determinados grupos sociales , algunos actos, como ponerse a dieta, cambiar de casa o de instituto, terminar una relación sentimental, la muerte de un familiar y el estrés emocional.
Factores de riesgo de la anorexia nerviosa
Las niñas y mujeres adolescentes son más propensas a sufrir esta enfermedad. El paciente que haya tenido un pariente que ha sufrido anorexia en alguna ocasión, corre más riesgo de padecerla por los cambios en los genes específicos y, si ya se ha padecido anorexia previamente o no se reconoce el problema, también es más fácil sufrir recaídas.
Complicaciones de la anorexia nerviosa
La anorexia puede tener muchas complicaciones, algunas de ellas especialmente graves:
No reconocer la enfermedad y convertirla en un estilo de vida.
Disminución de glóbulos blancos y aparición de infecciones.
Pérdida del conocimiento.
Arritmias.
Convulsiones.
Deshidratación.
Debilitamiento de los huesos.
Caries dental.
Fallecimiento.
Prevención de la anorexia nerviosa
Algunas recomendaciones útiles para prevenir la anorexia son:
Tener buenos hábitos alimentarios: comer siguiendo unos horarios preestablecidos, hacerlo sentado…etc.
No aislarse socialmente.
Mantener la comunicación con la familia.
Evitar mirarse al espejo con frecuencia.
Eludir la báscula y pesarse constantemente.
Acudir a psicoterapia individual, familiar o con grupos de apoyo.
Especialidades a las que pertenece la anorexia nerviosa
El diagnóstico y tratamiento de la anorexia nerviosa es multidisciplinar, normalmente es realizado de forma coordinada por la los especialistas en medicina familiar, medicina interna, psiquiatría, psicología, endocrinología y ginecología.
Preguntas frecuentes:
¿Cuáles son los tipos de anorexia?
En los tipos de anorexia nerviosa se puede diferenciar un subtipo restrictivo , en el cual el enfermo disminuye de peso mediante dietas, una restricción alimentaria y la realización de ejercicio físico intenso o, un subtipo bulímico , compulsivo o purgativo, en el que el enfermo recurre a atracones de comida para después desprenderse de lo comido provocándose vómitos o tomándose laxantes.
¿Qué tipo de enfermedad es la anorexia?
La anorexia es un trastorno de la conducta alimentaria, habitualmente con origen neurótico o psiquiátrico.
¿Cuáles son las principales causas de la anorexia?
Las principales causas de la anorexia tienen un origen psicológico (trastornos obsesivos, depresión, insatisfacción personal…), s ociocultural (patrones de belleza establecidos en países occidentales y presión de grupos sociales a los que pertenece el individuo) y/o genético (antecedentes en familiares de primer grado).
¿Qué es la anorexia nerviosa purgativa?
La anorexia nerviosa purgativa consiste en darse atracones de comida para posteriormente purgarse o eliminar los alimentos ingeridos mediante la toma de diuréticos, laxantes o la provocación auto inducida de vómitos.
¿Qué es la bulimia?
La bulimia es un trastorno de la conducta alimentaria consistente en la toma recurrente y descontrolada de grandes cantidades de comida (atracones), que después provocan en el enfermo un fuerte sentimiento de vergüenza o culpabilidad , derivando en la auto provocación de vómitos o la toma de laxantes para tratar de eliminar los alimentos y calorías ingeridos.
Enfermedad
Pie Diabético
¿Qué es el pie diabético?
El pie diabético es una complicación frecuente de la diabetes , producida por la afectación de los nervios y las arterias de los pies de la persona que la padece, que provoca pérdida de sensibilidad y una mala circulación de la sangre en los mismos. Estas dos circunstancias hacen más probable que se produzcan cortes, erosiones y heridas en los pies que, de no tratarse de forma rápida y adecuada, pueden evolucionar hacia la formación de úlceras, que pueden llegar a necesitar la amputación progresiva del miembro afectado. Dependiendo de la edad, sexo y tipo de población, la incidencia en los países de nuestro entorno de pie diabético oscila entre el 4 y el 10% de los pacientes diabéticos y la de padecer una úlcera en los pies está en torno al 15%, estimándose que, de estos, aproximadamente la tercera parte provocarán la amputación. Por lo tanto es un proceso que si bien en fases iniciales puede parecer leve puede llegar a ser muy grave.
Tipos de pie diabético
Existen diferentes tipos de pie diabético según la causa que lo ha producido:
Úlcera neuropática : producida en una zona de presión o deformidad del pie y caracterizada por no tener alteración en la circulación del mismo, pero sí en su sensibilidad.
Úlcera neuroisquémica : tiene una causa mixta ya que existe afectación de la circulación sanguínea con una pérdida de sensibilidad previa y que se suele localizar en la zonas lateral de los dedos y el talón.
Pie diabético infectado : se produce cuando una úlcera se sobreinfecta por algún germen patógeno y que puede presentarse de tres formas, como celulitis superficial (la más frecuente y leve), como infección necrotizante (provocando abscesos que se extienden por la planta del pie), o como osteomielitis (la infección alcanza al hueso y a la médula ósea)
Artropatía neuropática : se inicia en una lesión ósea como luxaciones o fracturas que pasan casi desapercibidas y al cabo de poco tiempo se acompañan de lesión ulceral.
Existen además diferentes sistemas para medir la gravedad de la afectación del pie diabético en función de varios criterios, siendo las más utilizadas la clasificación de Meggitt-Wagner y la clasificación de Gibbons.
Causas del pie diabético
Las causas que provocan el pie diabético es una afectación neuropática que afecta a las terminaciones nerviosas del pie, produciendo pérdida de sensibilidad y una afectación vascular, sobre todo de las arterias del pie, que dificulta la circulación sanguínea. Ambos factores inciden en la producción de diversos tipos de heridas que pueden llegar a ulcerarse.
Síntomas del pie diabético
Los síntomas del pie diabético van a depender de la causa principal que los produce.
Asociado a la neuropatía diabética se pierde la percepción del dolor, se producen deformidades en determinadas zonas del pie por debilitamiento de la musculatura y sequedad de los pies.
Asociado a la enfermedad vascular, se produce dolor al caminar que obliga a pararse y que se conoce como “síndrome del escaparate” o claudicación intermitente, dolor en reposo , cambios en la coloración del pie, edemas (acúmulo de líquidos) y trofismo de la piel (cambios en la configuración de la piel, que se vuelve seca y fina).
Tratamiento para el pie diabético
El tratamiento más importante para el pie diabético es la prevención de la formación de úlceras. Cuando estas ya han aparecido, se deben tratar mediante curas locales que favorezcan la cicatrización de las mismas. Para ello es necesario el desbridamiento cuando existe tejido necrótico (retirada del tejido muerto ennegrecido) ya sea mediante el uso de pomadas que realizan desbridamiento enzimático o de forma manual y la aplicación de hidrogeles y apósitos hidrocoloides que favorezcan el crecimiento del tejido de granulación. Cuando existen signos de infección se deben utilizar o bien pomadas antibióticas en las curas o bien tomar antibióticos por vía oral o endovenosa si se precisa. Si la afectación vascular es importante puede requerir la intervención de un cirujano vascular para una más completa valoración. En caso de presencia de dolor se tratará con analgésicos.
Pruebas complementarias del tratamiento del pie diabético
El diagnóstico del pie diabético se realiza mediante la exploración física del paciente. No obstante, puede ser necesaria la realización de alguna prueba complementaria para hacer más eficaz el tratamiento, como la realización de cultivos del exudado de la úlcera en busca del germen causante de la infección, o la realización de eco-doppler para valorar el estado de la circulación sanguínea en la pierna y radiografías para descartar la osteomielitis. Se completa con análisis de sangre para valorar niveles de azúcar, proteínas y coagulación.
Factores desencadenantes del pie diabético
Los factores desencadenantes del pie diabético son la presencia de heridas que evolucionan a úlceras en pacientes con neuropatía y enfermedad vascular periférica como complicación de la diabetes que padecen.
Factores de riesgo del pie diabético
Son factores de riesgo de padecer pie diabético aquellos pacientes con:
Neuropatía periférica.
Enfermedad vascular periférica.
Retinopatía.
Nefropatía.
Que presenten deformidades óseas en los pies.
Antecedentes de ulceración previa
Consumo excesivo de alcohol.
Aislamiento social.
Complicaciones del pie diabético
Las complicaciones del pie diabético son:
Grandes úlceras que tardan en curar o que se infectan.
Celulitis, infecciones de la piel del pie.
Osteomielitis, infección de los huesos del pie.
Gangrena: tejido muerto al no haber circulación sanguínea.
Artropatía de Charcot.
Amputación total o parcial del pie.
Prevención del pie diabético
La prevención del pie diabético requiere:
Un buen control del nivel de azúcar en sangre.
Control periódico de la tensión arterial y de los niveles de colesterol.
No fumar ni beber alcohol.
Realizar una dieta equilibrada con aporte de proteínas, vitaminas y minerales.
Realizar ejercicio físico suave.
Utilizar un calzado adecuado y cómodo que se adapte al pie.
Cuidado diario de los pies para evitar heridas, ampollas, grietas, rozaduras y erosiones que incluye:
Lavado diario con agua templada.
Secado sin frotar con toallas suaves.
Aplicar crema hidratante sin alcohol.
Mantener uñas cortas y limadas usando tijeras de punta roma.
Alejar los pies de fuentes de calor.
No usar calcetines que presionen o con goma.
Evitar andar descalzo.
Especialidades a las que pertenece el pie diabético
Los especialistas que intervienen en el cuidado del pie diabético son, las enfermeras, para la realización de las curas y educación sanitaria, el área de endocrinología para cuidados de la diabetes, y dermatólogos y cirujanos vasculares para úlceras con mala evolución.
Preguntas frecuentes:
¿Qué es una úlcera isquémica?
La úlcera isquémica es la herida que se produce por una insuficiencia de riego sanguíneo que provoca la muerte de las células y se manifiesta por placas negras en la piel.
¿Tiene algo que ver el pie diabético con la diabetes?
El pie diabético es una complicación frecuente de la diabetes originada en la neuropatía y vasculopatía periférica que esta provoca, y que puede originar úlceras graves en los pies.
¿Qué es una úlcera diabética?
La úlcera diabética es la herida que se produce como consecuencia de padecer una diabetes y sus complicaciones en las terminaciones nerviosas y en los vasos sanguíneos. El lugar más frecuente donde se manifiesta es en los pies.
¿Cómo cuidar los pies de los diabéticos?
El cuidado de los pies en los pacientes diabéticos tiene como objetivo evitar la aparición de heridas que puedan provocar una ulceración. Para ello hay que mantener una serie de cuidados generales y otros específicos de los pies como:
Un buen control del nivel de azúcar en sangre.
Control periódico de la tensión arterial y de los niveles de colesterol.
No fumar ni beber alcohol.
Realizar una dieta equilibrada con aporte de proteínas, vitaminas y minerales.
Realizar ejercicio físico suave.
Utilizar un calzado adecuado y cómodo que se adapte al pie.
Cuidado diario de los pies para evitar heridas, ampollas, grietas, rozaduras y erosiones que incluye:
Lavado diario con agua templada.
Secado sin frotar con toallas suaves.
Aplicar crema hidratante sin alcohol.
Mantener uñas cortas y limadas usando tijeras de punta roma.
Alejar los pies de fuentes de calor.
No usar calcetines que presionen o con goma.
Evitar andar descalzo.
¿Qué es el mal perforante plantar?
El mal perforante plantar también se le conoce como úlcera neuropática que es un tipo de lesión del pie diabético y se le considera la complicación más grave producida por la neuropatía diabética. Se localiza en las zonas que soportan más presión del pie y su inicio es indoloro por lo que suele detectarse ya en fases evolucionadas.

Enfermedad
Hipoglucemia
¿Qué es la hipoglucemia?
La hipoglucemia es una bajada de la cantidad de azúcar en la sangre por debajo de 60 mg/ml. En los recién nacidos son más frecuentes en los niños pretérmino, llegando a ser hasta del 14% de los casos. En los niños a término suele darse como mucho en un 7%. Las hipoglucemias en los diabéticos son más frecuentes en pacientes con insulina o secretagogos que con otros tratamientos hipoglucemiantes. Es una situación urgente de revertir ya que es grave porque puede poner en peligro la vida del individuo.
Causas de la hipoglucemia
La causa principal de la hipoglucemia es la alteración hormonal a nivel de hipófisis y tiroides . También se puede producir en pacientes normales sin alteraciones hormonales por causa de falta de alimento, exceso de ejercicio , o descarga insulínica en el páncreas.
Síntomas de la hipoglucemia
Los síntomas son: malestar, cansancio, adormecimiento, temblor, sudoración profusa, palpitaciones, mareos, visión borrosa, dolor de cabeza, convulsiones y trastorno del comportamiento.
Tratamiento para la hipoglucemia
El tratamiento para la hipoglucemia es dar azúcar de forma rápida. Se puede dar un producto azucarado como pueden ser los zumos de frutas , o también se puede dar directamente un sobre de azúcar disuelto en un vaso de agua. En casos muy difíciles de revertir y en pacientes diabéticos, puede ser necesario darles Glucagón mediante inyección subcutánea.
Pruebas complementarias del tratamiento de la hipoglucemia
La prueba complementaria será la determinación de glucosa en sangre capilar, hasta normalización de la misma, cada media hora.
Factores desencadenantes de la hipoglucemia
Los factores desencadenantes de la hipoglucemia son la falta de aporte de hidratos de carbono en la dieta , o el exceso de insulina en la sangre.
Factores de riesgo de la hipoglucemia
Son factores de riesgo para sufrir hipoglucemia en los pacientes en tratamiento con insulina y con secretagogos como Repaglinida y Glibenclamida . Los largos periodos de ayuno sin ingesta de hidratos de carbono , el periodo neonatal en niños pretérmino que tienen más problemas en regular hormonalmente sus niveles de glucemia, y también en niños a término en especial si son hijos de madres diabéticas.
Complicaciones de la hipoglucemia
Daños neurológicos.
Convulsiones.
Pérdida de conocimiento.
Coma.
Prevención de la hipoglucemia
No realizar ejercicio en ayunas.
Ingesta adecuada de hidratos de carbono.
Control capilar de glucemia.
Especialidades a las que pertenece la hipoglucemia
En el caso de hipoglucemias neonatales se trata de control con pediatras neonatólogos, en el resto de casos, se controla por el endocrino.
Preguntas frecuentes:
¿Qué es la hipoglucemia en bebés?
La hipoglucemia en bebés es la bajada de azúcar que se puede producir en los recién nacidos, más frecuente en niños prematuros, en niños nacidos a término que presentan madres diabéticas en el embarazo, y en niños con retraso en el crecimiento intrauterino.
¿Qué puede ocasionar la hipoglucemia?
Las hipoglucemias se producen por el exceso de insulina o por la falta de hidratos de carbono. En personas con tratamiento con insulina o fármacos secretagogos (fármacos que producen la secreción de insulina), se pueden producir hipoglucemias. En los neonatos que no tienen aún una buena regulación hormonal también se produce por parte del organismo un exceso de insulina que es la que causa la hipoglucemia. Las personas que tienen largos periodos de ayuno pueden presentar una hipoglucemia por falta de ingesta.
¿Qué diferencia hay entre hiperglucemia e hipoglucemia?
Las hiperglucemias son valores por encima de lo normal de azúcar en sangre (son niveles normales entre 70 y 129 mg/dl). La hipoglucemia son valores por debajo de lo normal de azúcar en sangre . Para tener síntomas de hipoglucemia, la glucosa deberá de estar por debajo de 60 mg/dl.
¿Cuáles son los niveles normales de azúcar en sangre?
Los niveles normales de azúcar en sangre son diferentes antes y después de la ingesta, así, en ayunas se consideran normales niveles de entre 70 y 128 mg/ml, por encima de estas cifras se habla de hiperglucemia, cuando se ha consumido alimento se considera que a las dos horas de haberlo ingerido los niveles de azúcar deben estar por debajo de 140 mg/ml
¿Qué es la hipoglucemia reactiva?
La hipoglucemia reactiva o hipoglucemia postprandial es la que se produce unas cuatro horas después de comer y no necesita un tratamiento especial, salvo el regular la ingesta de alimentos. Suele ser suficiente con no comer alimentos azucarados con el estómago vacío y hacer cinco comidas al dia.

Enfermedad
Síndrome de Cushing
¿Qué es el síndrome de Cushing?
El síndrome de Cushing o hipercortisolismo, es la enfermedad que se produce por exceso de cortisol , ya sea por producción excesiva de las glándulas suprarrenales del enfermo, o por efecto yatrógeno, esto quiere decir, como consecuencia secundaria de la administración de fármacos para tratamientos. También hay tumores neuroendocrinos que pueden producir una sustancia similar al cortisol que puede dar lugar a este síndrome. Es un síndrome muy poco frecuente que se producen de entre 35 a 40 casos por cada millón de personas, y se considera una enfermedad grave.
Tipos de síndromes de Cushing
Los tipos de síndrome de Cushing son:
Síndrome de Cushing ACTH (Hormona AdenoCorticoTropa): dependiente, se produce por tumores en la hipófisis o por tumores que provocan que se segregue esta hormona.
Síndrome de cushing ACTH independiente : se produce por tumores suprarrenales o hiperplasia suprarrenal yatrogénicos .
Causas del síndrome de Cushing
La causa es el trastorno hormonal que produce un aumento de cortisol o la toma de manera mantenida de medicamentos que contienen corticoides por enfermedades de origen inflamatorio.
Síntomas del síndrome de Cushing
Son síntomas de síndrome de Cushing: obesidad central, cara de luna llena ( cara redondeada ), acné , hipertensión arterial, diabetes , dolor de espalda , alteraciones en el ciclo menstrual , hirsutismo , impotencia en los varones, aumento de la sed , aumento de la micción , debilidad muscular , estrías de color vino, hematomas frecuentes, debilidad , irritabilidad , depresión , ansiedad y la alteración de la autoestima .
Tratamiento para el síndrome de Cushing
El tratamiento del síndrome de Cushing debe estar enfocado a reducir el nivel de cortisol.
Cuando el nivel de cortisol esté elevado por una causa yatrogénica , esto es, por ingerir medicamentos, el médico desciende la dosis de manera paulatina. Si esto no es posible, se intentará que el paciente consuma la menor dosis posible y se establecerá una vigilancia estrecha de este.
Si la causa es un tumor en la glándula hipofisaria, el médico indicará tratamiento quirúrgico, radioterapia o quimioterapia, según sea necesario.
Cuando la producción se debe a un tumor suprarrenal , el médico indicará un tratamiento quirúrgico para extraer el tumor. Si el tumor no puede extraerse se tratará de bloquear la acción de la hormona mediante medicamentos.
Pruebas complementarias para el diagnóstico del síndrome de Cushing
Las pruebas complementarias para el diagnóstico del síndrome de Cushing consisten en técnicas para medir la cantidad de cortisol:
Análisis de orina de 24 horas.
La prueba de supresión se dará 1 mg. de Dexametasona y se mide el cortisol a las 24 horas. Se puede hacer con 2 mg. de Dexametasona y haciendo la tasación de cortisol a las 48 horas, en ambos casos se realiza sobre sangre venosa ,
Se realizarán también pruebas de imagen, ya sean ecografías, tomografías o escáneres para valorar tanto las glándulas suprarrenales como la hipófisis .
Factores desencadenantes del síndrome de Cushing
El principal factor desencadenante es el exceso de cortisol .
Factores de riesgo del síndrome de Cushing
El principal factor de riesgo para el síndrome de Cushing es la toma indiscriminada de fármacos corticoides de forma diaria.
Complicaciones del síndrome de Cushing
Diabetes mellitus.
Hipertensión arterial.
Disfunción eréctil.
Hirsutismo: desarrollo de vello en cantidad mayor de lo normal.
Depresión.
Ansiedad.
Insomnio.
Alucinaciones.
Ideas paranoides.
Pérdida de memoria.
Prevención del síndrome de Cushing
No tomar fármacos corticoides sin control médico .
Especialidades a las que pertenece el síndrome de Cushing
El especialista en el control del síndrome de Cushing será el especialista en endocrinología . En cuanto al tratamiento, este será responsabilidad, tanto del endocrinólogo, como del cirujano general en los casos de tumores en las glándulas suprarrenales que deben ser extirpados, o bien neurocirujanos en el caso de alteraciones en la glándula hipófisis.
Preguntas frecuentes
¿Qué es el cortisol en el cuerpo humano?
El cortisol es una hormona que, producida por la glándula suprarrenal , se encuentra circulando en la sangre. Aumenta en las situaciones de estrés y actúa elevando el nivel de azúcar en la sangre y disminuyendo la inmunidad. Interviene en el metabolismo de grasas, proteínas y carbohidratos, y también actúa manteniendo en niveles adecuados los iones en sangre, así como la cantidad de agua en el organismo.
¿Qué es la enfermedad de insuficiencia suprarrenal?
La insuficiencia renal es la enfermedad en la que las glándulas suprarrenales no funcionan . Esto da lugar a una menor producción de cortisol, que deberá ser suministrado en forma de medicamento al paciente.
¿Qué es la glándula suprarrenal?
La glándula suprarrenal es una glándula endocrina que se encuentra situada encima de los riñones, de ahí su nombre. Su misión principal es la producción de sustancias como el cortisol, la aldosterona, la adrenalina y noradrenalina. También producen, pero en menor cantidad hormonales sexuales, como los estrógenos y la testosterona.
¿Cuál es la función de la glándula suprarrenal?
La función de la glándula suprarrenal es la producción de hormonas como el cortisol, la aldosterona, la adrenalina y la noradrenalina, que van a controlar el equilibrio de iones del organismo, mantener los niveles de azúcar, regular la respuesta inflamatoria, permitir que el cuerpo responda ante una situación de lucha o huida, mantener el embarazo, y comenzar la maduración sexual durante la pubertad.
¿Dónde se producen los mineralocorticoides?
Los mineralocorticoides son las hormonas que se van a producir en la parte exterior o corteza de las glándulas suprarrenales. Su misión en el organismo es mantener el equilibrio hidroelectrolítico actuando a nivel del riñón. La más importante es la aldosterona .
Enfermedad
Hipotiroidismo
¿Qué es el hipotiroidismo?
El hipotiroidismo es el descenso de la hormona tiroidea por debajo de niveles normales , que se produce porque la glándula tiroidea no es capaz de producir suficiente hormona. Se conoce también como bocio , ya que se produce un aumento del tamaño de la glándula en el cuello para producir la hormona necesaria. El hipotiroidismo se presenta entre el 2,4 y 3,5 por cada cada mil habitantes en España y de todos ellos el 64% son de origen autoinmune. Además, es más frecuente en mujeres . Puede provocar coma mixedematoso, que puede llegar a ser mortal, pero el hipotiroidismo se considera una enfermedad crónica leve.
Tipos de enfermedades de la tiroides
Los tipos de hipotiroidismo son:
Hipotiroidismo congénito : es la falta de hormona tiroidea en los recién nacidos, puede ser debido a falta o alteración en la glándula tiroidea, o por alteraciones en la glándula hipofisaria. Para detectar este problema se hace un cribado en todos los recién nacidos.
Hipotiroidismo primario : se da cuando la alteración se produce en la glándula tiroidea.
Hipotiroidismo secundario : se da cuando la alteración está en la hipófisis, que no estimula de modo adecuado a la tiroides para que produzca hormona tiroidea.
Causas del hipotiroidismo
La causa más frecuente es la tiroiditis de Hashimoto , que es una causa autoinmune, en la cual las células de defensa del organismo van a destruir el propio tiroides. Esto es más frecuente en mujeres mayores de 40 años.
Otras causas son las quirúrgicas , que den lugar a extirpación del tiroides por nódulos o cánceres tiroideos, el uso de yodo radioactivo para tratar el hipertiroidismo, y los fármacos para el tratamiento de arritmias cardiacas como la Amiodarona.
Síntomas del hipotiroidismo
Los síntomas del hipotiroidismo son diversos, ya que la hormona tiroidea actúa como reguladora de múltiples funciones, pudiendo dar lugar a cansancio, aumento de peso, estreñimiento, intolerancia al frío, piel pálida y seca , edema facial, dolores musculares, elevación del colesterol, dolor y rigidez de las articulaciones, así como cambios en el ciclo menstrual, pelo y uñas quebradizas y olvidos frecuentes.
Tratamiento para el hipotiroidismo
El tratamiento para el hipotiroidismo es el aporte de hormona tiroidea sintética . Esta sustancia se llama Levotiroxina , y su dosis será variable para cada persona, además de poder variar con el tiempo en una misma persona.
Pruebas complementarias del tratamiento del hipotiroidismo
Las pruebas serán analíticas de sangre con determinación de hormona tiroidea, TSH (hormona que produce la hipófisis para estimular la tiroides), y los anticuerpos antitiroideos. En algunos casos pueden ser necesarias pruebas de imagen como ecografías o gammagrafías tiroideas.
Factores desencadenantes del hipotiroidismo
En la tiroiditis de Hashimoto la causa desencadenante es la producción de anticuerpos antitiroideos por parte del propio organismo, atacando a su propia tiroides.
Factores de riesgo del hipotiroidismo
Los factores de riesgo para el hipotiroidismo son la edad, tener antecedentes familiares de enfermedades tiroideas, tratamiento con yodo radioactivo y haber recibido radioterapia a nivel del cuello.
Complicaciones del hipotiroidismo
En el hipotiroidismo congénito las principales complicaciones son el r etraso mental, alteraciones del habla, retraso en el crecimiento y retraso en la madurez física.
En el hipotiroidismo en adultos la principal complicación es el mixedema, que puede conducir al coma.
Prevención del hipotiroidismo
No hay formas conocidas de prevenir el hipotiroidismo.
Especialidades a las que pertenece el hipotiroidismo
El hipotiroidismo se trata a través del endocrinólogo.
Preguntas frecuentes:
¿Qué es la glándula tiroides?
La glándula tiroides es la glándula que produce la hormona tiroidea , se centra en la parte delantera del cuello y que tiene dos lóbulos, uno derecho y otro izquierdo que se unen por medio de un puente en el centro. Cada lóbulo tiroideo mide entre 4 y 6 cm.
¿Engordaré mucho por tener hipotiroidismo?
Es posible que presentar hipotiroidismo produzca ganancia de peso, de hecho, es uno de los síntomas que puede hacer llegar al diagnóstico de esta enfermedad, pero en el momento que el paciente empiece a tener tratamiento con hormona tiroidea su peso volverá a ser normal.
¿Qué diferencia el hipertiroidismo del hipotiroidismo?
El hipertiroidismo es cuando la tiroides produce más hormona de la que se debe, por tanto hay un nivel hormonal elevado, en el hipotiroidismo se produce una disminución de hormona , esto quiere decir que la tiroides produce menos hormona de la necesaria.
¿Qué relación hay entre el hipotiroidismo y el embarazo?
Se denomina hipotiroidismo gestacional. La relación de hipotiroidismo y embarazo es que una persona embarazada no debe estar hipotiroidea ya que aumenta el riesgo de complicaciones en el embarazo y se produce un mayor número de abortos.

Enfermedad
Hipertiroidismo
¿Qué es el hipertiroidismo?
El hipertiroidismo es la enfermedad en la cual la glándula tiroides, que se sitúa en la zona del cuello, produce una cantidad mayor de lo normal de hormona tiroidea , cuando la causa es autoinmune se conoce como enfermedad de Graves Basedow. Es un enfermedad que afecta al 1 por ciento de la población y es más frecuente en mujeres entre los 30 y 40 años. Se considera una enfermedad leve.
Tipos de enfermedades de la tiroides
Hipotiroidismo: cuando el tiroides produce menos hormona de la debida. Hipertiroidismo: cuando el tiroides produce más hormona de lo debido. Bocio: aumento del tamaño del tiroides. Cáncer de tiroides: tumoración maligna del tiroides. Tiroiditis : inflamación de tiroides. Nódulos tiroideos: bultos dentro de la glándula tiroidea.
Causas del hipertiroidismo
Las causas del hipertiroidismo son la enfermedad de Graves Basedow , esta es la causa más frecuente, otras causas menos frecuentes son la tiroiditis por inflamación del tiroides, tras el embarazo o por enfermedades virales, tumores de la glándula tiroidea o de la hipófisis, tumores de ovario o testicular, tomar productos con exceso de yodo, ingerir exceso de hormona tiroidea frecuentes.
Síntomas del hipertiroidismo
Los síntomas del hipertiroidismo son variados ya que afectan a diferentes órganos, puede haber dificultad para concentrarse, temblor de manos, nerviosismo o ansiedad, diarrea, pérdida de peso, intolerancia al calor, aumento de la sudoración, pérdida de pelo, pérdida de las cejas, insomnio, alteraciones en la regla en las mujeres, palpitaciones.
Tratamiento para el hipertiroidismo
El tratamiento para el hipertiroidismo suele comenzar por fármacos antitiroideos como propiltiouracilo y el tiamazol, en casos más graves puede ser necesario dar yodo radioactivo o incluso someterse a cirugía para extirpar el tiroides.
Pruebas complementarias del tratamiento del hipertiroidismo
Las pruebas complementarias para el hipertiroidismo serán pruebas de laboratorio , con control de hormona tiroideas, TSH y anticuerpos antitiroideos, las pruebas de imagen serán ecografía tiroidea , en casos necesarios se hará una gammagrafía tiroidea para valorar la captación de los nódulos tiroideos.
Factores desencadenantes del hipertiroidismo
Los factores desencadenantes del hipertiroidismo pueden ser enfermedades autoinmunes, exceso de consumo de hormona tiroidea y exceso de consumo de alimentos con yodo , en este último caso sólo se produce si la glándula estaba enferma previamente.
Factores de riesgo del hipertiroidismo
Son factores de riesgo para el hipertiroidismo la presencia en familiares de primer grado de enfermedades de tiroides, los cánceres de ovario y testículo, y el postparto .
Complicaciones del hipertiroidismo
Crisis hipertiroidea, puede llegar a poner en peligro la vida del enfermo.
Problemas cardiacos.
Osteoporosis
Prevención del hipertiroidismo
Realmente el hipertiroidismo no se puede prevenir salvo en los casos que se debe a un exceso de aporte de hormona tiroidea o bien a exceso de yodo en la dieta.
Especialidades a las que pertenece el hipertiroidismo
El hipertiroidismo deberá de ser controlado por el endocrino y en caso necesario por el cirujano general u otorrino, que serán los encargados de hacer la exéresis del tiroides
Preguntas frecuentes:
¿Qué es la glándula tiroides?
La glándula tiroides es un órgano productor de una sustancia reguladora que se conoce como hormona tiroidea , la glándula se sitúa en la parte delantera del cuello. La hormona tiroidea es una hormona importante ya que actúa controlando diferentes funciones del cuerpo.
¿Me quedaré muy delgado por tener hipertiroidismo?
Uno de los síntomas del hipertiroidismo es la pérdida de peso, no todos los pacientes pierden peso y de ser así no todos lo pierden de forma importante, no obstante, es un proceso que revierte rápidamente con la medicación antitiroidea.
¿Qué diferencia el hipertiroidismo del hipotiroidismo?
La diferencia entre el hipertiroidismo y el hipotiroidismo es la cantidad de hormona que produce el tiroides. En el hipertiroidismo la hormona se produce en exceso, en el hipotiroidismo hay una falta de producción de hormona tiroidea.
¿Qué relación hay entre el hipertiroidismo y el embarazo?
Durante el embarazo la hormona de la madre suele estar algo más elevada, esto se produce porque el feto necesita de hormona para poder desarrollar su cerebro .
En las situaciones en que la madre tenía un hipertiroidismo previo, debe de estar estabilizada y sin tratamiento antitiroideo durante al menos tres meses antes de pensar en un embarazo, siendo necesaria una buena planificación del mismo. Debe ser consultado con el endocrino que siga a la paciente. En casos de crisis hipertiroideas durante el embarazo debe de tratarse de forma adecuada, ya que en esta situación se producen abortos y partos prematuros.
Enfermedad
Diabetes Tipo 2
¿Qué es la diabetes tipo 2?
La diabetes tipo 2 o diabetes del adulto es la enfermedad crónica que produce alteración en los niveles de azúcar de la sangre, que se encuentran por encima de lo normal . Padece diabetes tipo 2 aproximadamente un 12% de las personas mayores de 18 años en España, de ellas, aproximadamente un tercio desconocen padecer la enfermedad. Los mayores riesgos que presenta la diabetes tipo 2 son las urgencias cardiovasculares y las hipoglucemias. Se considera una enfermedad potencialmente grave.
Tipos de diabetes
Los tipos de Diabetes son:
Diabetes mellitus tipo 1 : es la diabetes de las personas jóvenes y los niños, se produce por reacción autoinmune (las células del propio organismo le atacan).
Diabetes tipo 2 : es la diabetes de los adultos, relacionada con la obesidad y la resistencia a la insulina.
Diabetes tipo LADA : es una diabetes tipo 2 pero en la cual se encuentran anticuerpos como en la diabetes tipo 1.
Diabetes gestacional : es la que se produce durante el embarazo y predispone a una diabetes tipo 2 posterior.
Causas de la diabetes tipo 2
La diabetes tipo 2 no está claramente relacionada con una causa, sino con una serie de factores tanto genéticos como ambientales.
Síntomas de la diabetes tipo 2
La diabetes tipo 2 puede ser asintomática durante un tiempo. Los síntomas más frecuentes son beber mucha agua, pérdida de peso, comer mucho y orinar en grandes cantidades . En ocasiones se tiene sensación de cansancio. Pueden aparecer síntomas de las complicaciones cardiovasculares como infartos, claudicación intermitente (problemas circulatorios en las piernas), alteraciones renales, oculares y neuropatías (daño de los nervios por aumento del azúcar).
Tratamiento para la diabetes tipo 2
El tratamiento de la diabetes tipo 2 se ha de basar en una dieta correcta para diabéticos y ejercicio físico continuado.
Los fármacos a usar son múltiples y cada paciente puede necesitar uno o varios de ellos en diferentes combinaciones. Siempre que pueda tolerarse, es importante el uso de Metformina , que se considera el fármaco de inicio en todas las guías de endocrinología. Posteriormente se pueden usar sulfonilureas, inhibidores de la DPP 4, glitazonas, glinidas, inhibidores de SGLT2, fármacos inyectables como los análogos de GLP 1 y por último la insulina , serán los últimos fármacos a usar.
Será el endocrino quien, según las características del paciente, decida qué fármaco de la amplia gama ahora disponible, puede ser más beneficioso para cada paciente, ayudando a un mejor control de los niveles de glucosa en sangre.
Pruebas complementarias del tratamiento de la diabetes tipo 2
En las pruebas complementarias de la diabetes, serán necesarios los controles glucémicos y perfiles (control mediante máquinas portátiles que tiene el paciente y se realiza seis veces al día), para comprobar un buen control o la variabilidad de los niveles a lo largo del día. Actualmente existe en el mercado un sistema de control glucémico mediante parche con lectura a través de la piel sin necesidad de pinchazos en el dedo. Para el control de las complicaciones, además de analíticas de sangre se debe hacer control de fondo de ojo , bianual si es normal y anual si presenta patología. Por último, se realizará un electrocardiograma también bianual o antes si hay síntomas sugerentes de posible daño vascular.
Factores desencadenantes de la diabetes tipo 2
La diabetes tipo 2 presenta un origen multifactorial con una predisposición genética y factores ambientales asociados.
Factores de riesgo de la diabetes tipo 2
La obesidad, con una dieta rica en alimentos procesados y pobre en frutas y verduras, la vida sedentaria y la edad , son las causas que favorecen la diabetes tipo 2.
Las mujeres que han padecido diabetes gestacional, mujeres con ovarios poliquísticos y personas con familiares de primer grado con diabetes, también tienen mayor riesgo de padecerla.
Existen también razas con mayor riesgo de diabetes, tales como los africanos, los latinoamericanos y las personas de las islas del Pacífico.
Complicaciones de la diabetes tipo 2
Infecciones.
Infarto cardíaco o cerebral.
Claudicación intermitente (problemas circulatorios en las piernas).
Neuropatía (alteración en los nervios).
Úlceras arteriales en los pies.
Insuficiencia renal.
Alteraciones en la retina.
Cataratas.
Impotencia.
Prevención de la diabetes tipo 2
Realizar una dieta sana.
Evitar la obesidad.
Realizar ejercicio físico.
Especialidades a las que pertenece la diabetes tipo 2
Los especialistas que seguirán la diabetes tipo 2 serán el endocrino y el médico de familia, pero puede ser necesario un equipo multidisciplinar, con cardiólogos, cirujanos vasculares, neurólogos y oftalmólogos para controlar las complicaciones que la enfermedad puede presentar.
Preguntas frecuentes:
¿Puedo desarrollar diabetes en cualquier momento de mi vida?
La diabetes tipo 2 es una enfermedad relacionada con el envejecimiento, se da por tanto en personas mayores de 50 años , aunque puede darse también en personas menores de esa edad. Por otra parte la diabetes gestacional se da en mujeres en edad fértil, siendo más frecuente en las mayores de 35 años pero sin ser exclusiva de ellas. Por último, la diabetes tipo 1 se da en niños y adolescentes principalmente.
¿Es hereditaria la diabetes?
La diabetes tiene un herencia por múltiples genes, en los que se hereda la tendencia a tener la enfermedad pero no la enfermedad en sí , esto quiere decir que si una persona tiene familiares con diabetes tipo 2 de primer grado, es más frecuente que tenga la enfermedad, pero porque su padre o madre la tengan no tiene por qué padecerla.
¿Cómo se detecta la diabetes?
La diabetes se detecta por sus síntomas principales, como son beber mucha agua, comer mucho, perder peso, y orinar muchas veces. Con estos datos el médico realizará una analítica de sangre donde, en caso de tener diabetes, se encontrará un nivel de azúcar por encima de valores normales.
¿Puede un diabético tomar dulces?
El tratamiento base de la diabetes es la dieta sana, dicha dieta no debe contener ningún alimento preparado, y además deberá carecer de alimentos con azúcares refinados . Un diabético no debe comer dulces ya que esto se traducirá en una elevación importante de sus niveles de azúcar.

Enfermedad
Cetoacidosis Diabética
¿Qué es la cetoacidosis diabética?
La cetoacidosis diabética es una complicación grave de la diabetes que ocurre cuando el organismo produce niveles elevados de unos ácidos presentes en la sangre denominados cuerpos cetónicos. Es un estado metabólico agudo y extremo de la diabetes, que se caracteriza por hiperglucemia, hipercetonemia y acidosis metabólica, causados por la deficiencia de insulina . Esto pasa cuando el cuerpo empieza a descomponer la grasa demasiado rápido, que provoca que el hígado convierte la grasa en un impulsor llamado cetona que hace que la sangre se vuelva ácida. Es frecuente en personas con diabetes tipo 1, y solo el 10-20% corresponde a la diabetes mellitus tipo 2. Su incidencia anual de 4 a 8 episodios por cada 1.000 pacientes , y es la causa más importante de morbilidad y mortalidad en los niños que presentan diabetes mellitus, aunque la tasa de mortalidad total es de >5%. Es una enfermedad común que si no se trata puede ser grave.
Causas de la cetoacidosis diabética
El trastorno aparece cuando el organismo no puede producir suficiente insulina. Normalmente, la insulina desempeña una función crucial en el paso del azúcar (glucosa) a las células. Sin suficiente insulina, el organismo comienza a descomponer las grasas para obtener energía. Este proceso produce una acumulación en el torrente sanguíneo de ácidos denominados cuerpos cetónicos que, con el tiempo, provocan cetoacidosis diabética si no se administra el tratamiento correspondiente.
Una infección u otra enfermedad pueden hacer que el organismo produzca niveles más elevados de determinadas hormonas, como la adrenalina o el cortisol . Lamentablemente, las hormonas de este tipo contrarrestan el efecto de la insulina, lo que a veces desencadena un episodio de cetoacidosis diabética.
Si los tratamientos de insulina no se administran o si la terapia de insulina se administra de forma inadecuada, el sistema puede quedar con una cantidad muy reducida de insulina y esto puede ocasionar cetoacidosis diabética.
Síntomas de la cetoacidosis diabética
Los signos y síntomas de la cetoacidosis diabética suelen presentarse rápidamente, a veces dentro de las 24 horas.
Los síntomas de la cetoacidosis diabética incluyen: sed excesiva, náuseas y vómitos , necesidad de orinar a menudo (poliuria), dificultad respiratoria o falta de aire , dolor abdominal, debilidad o fatiga y cansancio, estado de confusión , aliento con olor afrutado, enrojecimiento de la cara, sequedad en boca y piel, y pérdida de peso.
Tratamiento para la cetoacidosis diabética
El objetivo del tratamiento es corregir el alto nivel de glucosa en sangre con insulina. Otro objetivo es reponer los líquidos perdidos a través de la orina, y paliar la falta de apetito y el vómito si se tienen estos síntomas. Por lo general, el tratamiento consiste en una sustitución de la reposición de líquidos , ya sea por vía oral o intravenosa, hasta que el paciente esté nuevamente hidratado. Los líquidos ayudarán a diluir el exceso de azúcar en la sangre.
Después es necesaria una sustitución de electrolitos , que son minerales como el sodio, el potasio y el cloruro, que se encuentran en la sangre y que conducen una carga eléctrica, generalmente cerebral.
La falta de insulina puede disminuir el nivel de electrolitos en sangre. Estos se administrarán por vía intravenosa para mantener el correcto funcionamiento del corazón, de los músculos y de las neuronas. Por último, se realiza una terapia de insulina , que revierte los procesos que generan la cetoacidosis diabética. La mayoría de personas responden al tratamiento dentro de las primeras 24 horas, aunque a veces toma más tiempo recuperarse.
Pruebas complementarias del tratamiento de la cetoacidosis diabética
Para el tratamiento de la cetoacidosis diabética se realizan pruebas como una exploración física y varios análisis de sangre . Estos análisis utilizados en el diagnóstico y tratamiento de la enfermedad miden el nivel de cuerpos cetónicos, así como el nivel de acidez y azúcar en sangre.
Factores desencadenantes de la cetoacidosis diabética
El factor desencadenante principal para la cetoacidosis diabética es la diabetes tipo 1 , en especial en personas que aún no han recibido el diagnóstico.
Factores de riesgo de la cetoacidosis diabética
Los factores que aumentan el riesgo de la cetoacidosis diabética incluyen: tener diabetes tipo 1, omitir las dosis de insulina con frecuencia o no tener un tratamiento para la diabetes, el abuso de alcohol o drogas , especialmente de cocaína, una infección aguda (especialmente neumonía e infecciones urinarias) y traumatismos, entre otros factores.
Complicaciones de la cetoacidosis diabética
Las complicaciones de la cetoacidosis diabética incluyen:
Bajo nivel de azúcar en sangre (hipoglucemia).
Inflamación en el cerebro.
Nivel bajo de potasio (hipokalemia).
Recaída de la cetoacidosis.
Fenómenos trombóticos.
Alergia insulínica.
Prevención de la cetoacidosis diabética
Para prevenir la cetoacidosis diabética es necesario:
Un correcto tratamiento para la diabetes.
El control del nivel de azúcar en sangre.
Evitar la omisión del tratamiento.
Educar al paciente.
Llevar una dieta hipocalórica.
Controlar el nivel de cuerpos cetónicos.
Especialidades a las que pertenece la cetoacidosis diabética
La cetoacidosis diabética pertenece a la especialidad de endocrinología , que es la especialidad médica que estudia las glándulas que producen las hormonas, es decir, las glándulas de secreción interna o glándulas endocrinas. Estudia los efectos normales de las secreciones del organismo y los trastornos derivados del mal funcionamiento de las mismas.
Preguntas frecuentes:
¿Qué es un paro diabético?
Un coma o paro diabético es una complicación de la diabetes que pone en riesgo la vida del paciente y produce la pérdida de conciencia . Si se tiene diabetes, los niveles peligrosamente altos de azúcar en sangre o hiperglucemia, o los niveles peligrosamente bajos de azúcar en sangre o hipoglucemia, pueden provocar este coma o paro diabético.
¿Qué es el aliento cetónico?
El aliento cetónico se produce por la descomposición espontánea del ácido acetoacético. El olor asemeja al de fruta en estado de descomposición.
¿Qué es entrar en cetosis?
Para entrar en cetosis se necesita un nivel bajo de insulina, la hormona de almacenamiento de grasa. La manera principal de que esto se produzca es seguir una dieta estricta baja en carbohidratos , también llamada dieta cetogénica.
¿Cuánto tiempo se tarda en entrar en cetosis?
Consumiendo la cantidad recomendada de carbohidratos, grasa e ingesta de líquido, el cuerpo puede tardar entre tres y cinco días para entrar en cetosis.
¿Qué es la dieta de cetosis?
La dieta cetogénica es una dieta muy baja en carbohidratos que convierte el cuerpo en una máquina de quemar grasa. Tiene muchos beneficios potenciales para la pérdida de peso, la salud y el rendimiento deportivo.
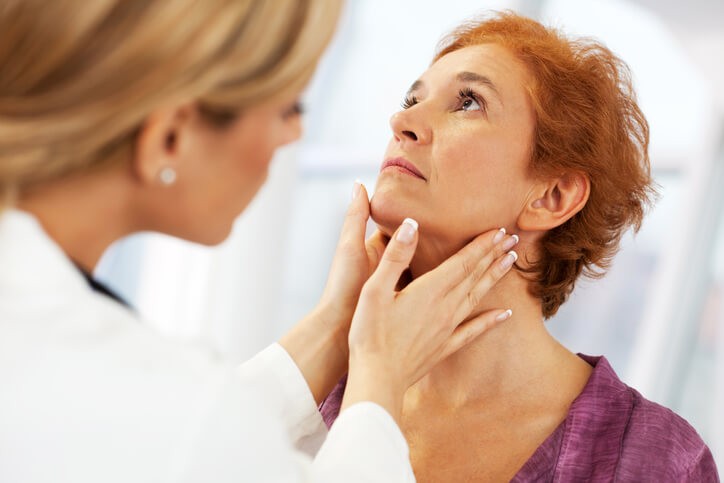
Enfermedad
Bocio
¿Qué es el bocio?
El bocio es un aumento de la glándula tiroidea que puede aparecer en el contexto de distintas alteraciones del tiroides, que es la glándula situada en la parte anterior e inferior del cuello , que produce distintas hormonas, encargadas de regular diversos procesos del metabolismo del cuerpo. El bocio llamado simple endémico, según la Organización Mundial de la Salud, se da en un 13% de la población mundial . El bocio nodular o multinodular es también un hallazgo frecuente, apareciendo en el 4-7% de la población adulta, siendo más frecuente en la mujer. Salvo que en el origen de la producción de bocio se sospeche de la existencia de un tumor, o haya alteraciones importantes de la función hormonal del tiroides o por compresión de estructuras adyacentes, el bocio no es una patología grave , ni precisa de una atención urgente.
Tipos de bocios
Existen dos formas de clasificación del bocio:
Por un lado, podemos dividir el bocio según su tamaño :
0 – No visible y no palpable.
1 – Palpable pero no visible.
2 – Visible y palpable.
Por otro lado, según sus características anatómicas:
Bocio simple difuso : consiste en un aumento del tamaño del tiroides de forma difusa o global, no producido por procesos inflamatorios ni tumorales, manteniendo habitualmente el tiroides su función con normalidad. Puede ser endémico, cuando afecta a más de un 10% de una población, o esporádico.
Bocio nodular o multinodular no tóxico : se trata de la formación de una concreción de tejido tiroideo que forma un nódulo o varios (multinodular), cuyo principal problema clínico es la posibilidad de que deriven en lesiones malignas tumorales.
Bocio multinodular tóxico : aumento del tamaño tiroideo con incremento de la producción de hormonas tiroideas, lo que produce hipertiroidismo.
Causas del bocio
La causa conocida de bocio simple difuso más frecuente es el déficit de yodo en el cuerpo, debido a que el yodo es fundamental para la producción de las hormonas tiroideas y cuando en el organismo no hay yodo suficiente, la glándula crece para captar más yodo. Puede aparecer también por alteración en la formación de hormonas tiroideas o la ingesta de sustancias bociógenas (repollo, coliflor, nabo, etc).
La causa más importante de bocio multinodular no tóxico es el bocio simple, que con el tiempo, produce nódulos múltiples y que, incluso, puede acabar en bocio multinodular tóxico (con mal funcionamiento de la glándula tiroides y aparición de hipertiroidismo).
Otras causas de bocio son alteraciones inflamatorias (tiroiditis), como enfermedades autoinmunes (el propio sistema de defensa del organismo actúa contra el tejido tiroideo), procesos infecciosos, y alteraciones congénitas (quistes tiroglosos, tumoraciones malignas y benignas…etc.)
Síntomas del bocio
El bocio simple produce síntomas dependiendo del tamaño que presente. El paciente nota un aumento del tamaño en la región anterior del cuello. Así, se puede producir compresión de órganos adyacentes, desencadenando síntomas como sensación de falta de aire (disnea), dificultad para tragar (disfagia), sensación de opresión en el cuello, y en casos excepcionales, ronquera. En bocios de gran tamaño, puede aparecer el llamado signo de Pemberton, que consiste en la aparición de congestión facial y coloración azulada de la piel (cianosis), dificultad respiratoria e incluso mareo y síncope (pérdida de conocimiento), cuando se elevan los brazos, producido por la compresión que ejerce el bocio sobre los vasos sanguíneos cervicales.
En el bocio nodular o multinodular, el principal motivo de consulta por el paciente es la propia palpación en su cuello de un nódulo. Pueden aparecer también síntomas producidos por compresión, como alteración de la voz (disfonía), dificultad para tragar… etc. Se debe sospechar de la derivación del o de los nódulos a una tumoración maligna cuando su crecimiento sea rápido, la consistencia dura cuando se palpa, cuando no son móviles y están fijados al resto de tejidos o si se detectan otros “bultos” en cuello que pueden corresponder a ganglios linfáticos (estaciones del sistema de defensa del organismo), aumentados de tamaño de forma anormal por el proceso tumoral.
Tratamiento del bocio
Si el paciente presenta síntomas de compresión importantes se realiza una cirugía para la extracción de parte del tiroides , conocida como tiroidectomía subtotal.
Si no existe clínica de compresión, en principio no se realiza tratamiento y se somete al paciente a observación y realización periódica de ecografías de tiroides, recomendando aumentar la ingesta de yodo en la dieta.
Cuando se establece que es preciso por el aumento del tamaño del tiroides, se puede realizar un tratamiento con la administración de yodo radioactivo (I-131), una terapia de medicina nuclear en la que se traga una pequeña dosis de yodo I-131 radiactivo (un isótopo del yodo que emite radiación), que es absorbido hacia el torrente sanguíneo, concentrándose en el tiroides, donde comienza a destruir las células de la glándula. En estos pacientes se deben hacer controles periódicos de hormonas tiroideas mediante análisis de sangre, ya que, al destruir el tejido tiroideo, se corre el riesgo de que se disminuya su función y formación las hormonas, produciendo un hipotiroidismo.
Otra alternativa es la administración de levotiroxina (una de las hormonas que produce el tiroides), en dosis que disminuyan la función del tiroides (ya que al detectar el organismo que hay suficiente hormona tiroidea, manda la orden desde una región cerebral llamada hipotálamo, para que el tiroides deje de formar la hormonas). Se hace una control del tamaño tiroideo a los 3-6 meses para ver la efectividad en la disminución del tamaño del tiroides.
Pruebas complementarias del tratamiento y diagnóstico del bocio
Se realiza una analítica de sangre para determinar los niveles de TSH (hormona tiroestimulante), con la cual se puede evaluar la función del tiroides y la producción de sus hormonas. Además, se determina en la analítica sanguínea la presencia de anticuerpos antitiroideos (moléculas producidas por el sistema de defensa del organismo que “atacan” de forma errónea al tiroides en las patologías de origen autoinmune).
También se procede a realizar una ecografía cervica l para valorar el tamaño del tiroides y detectar la presencia de nódulos. En ocasiones, puede ser precisa la realización de una radiografía de tórax para descartar el crecimiento del bocio hacia el interior de la cavidad torácica o la compresión de la tráquea (tubo del sistema respiratorio que conecta la laringe con los bronquios).
Otras pruebas de imagen que pueden realizarse si se precisa, son el TAC y la resonancia magnética nuclear (RMN), que son útiles para valorar grandes bocios y determinar su extensión y la relación con las estructuras vecinas.
Si se establece preciso, se realiza una gammagrafía tiroidea , prueba de medicina nuclear que sirve para obtener una imagen funcional del tiroides y valorar si existe disfunción de la glándula.
Por último, en caso de sospechar que los nódulos presentes en el bocio nodular o multinodular pueden tener un origen tumoral maligno, se realiza una PAAF (punción aspiración con aguja fina), que es la extracción de una pequeña muestra de tejido para su análisis en el laboratorio de anatomía patológica.
Factores de riesgo y desencadenantes del bocio
Se puede considerar un factor de riesgo fundamental para padecer bocio el tener un déficit de yodo en la dieta.
Otros factores de riesgo son el ser mujer, tener una edad mayor a 50 años, fumar, tomar muchos alimentos bociógenos o medicamentos que aumenten el riesgo de bocio (litio, Amiodarona …etc), el embarazo, haber recibido radiación en el cuello o tener antecedentes familiares de patologías tiroideas como enfermedades autoinmunes o tumores de tiroides.
Complicaciones del bocio
Complicaciones derivadas del aumento de tamaño y compresión de estructuras vecinas del tiroides: alteración de la deglución, la respiración, la voz, etc.
En los casos en los que se produzca una disfunción del tiroides puede aparecer hipertiroidismo , que si no se controla llega a producir alteraciones graves como crisis cardíaca por descompensación del corazón, arritmias e insuficiencia cardíaca, alteraciones neurológicas o aumento de la temperatura corporal no controlada (hipertermia). Si se produce una disminución de las hormonas tiroideas sin su detección y tratamiento, puede darse otra situación grave llamada coma mixedematoso , con disminución del nivel de consciencia, hipotermia o disminución de la temperatura corporal.
Prevención del bocio
Un factor fundamental para la prevención del bocio simple es la ingesta de sal yodada de mesa en la dieta y de alimentos que contienen yodo (bacalao fresco, mejillones, atún…etc).
Es importante también establecer los controles analíticos necesarios cuando se toman fármacos bociógenos y de forma rutinaria para detectar alteraciones en la función del tiroides.
Especialidades a las que pertenece el bocio
El bocio puede ser diagnosticado por el médico de familia. Si este determina la necesidad de evaluación especializada, remitirá a la consulta del endocrino.
Preguntas frecuentes:
¿Qué enfermedades se producen por falta de yodo?
La falta de yodo en el organismo puede desencadenar el padecimiento de bocio , al aumentar la glándula tiroidea su tamaño con intención de elevar la absorción de este elemento. También puede darse una disfunción del funcionamiento del tiroides, que deja de producir suficiente hormona tiroidea (ya que necesita el yodo para su formación), lo que se denomina hipotiroidismo.
¿Cuál es la diferencia entre el bocio y la tiroides?
El tiroides es un órgano del cuerpo humano encargado de producir hormonas que intervienen en múltiples procesos del metabolismo corporal. El bocio es el aumento del tamaño de este órgano.
¿El bocio siempre afecta al cuello?
El bocio puede afectar al cuello y si el tiroides aumenta mucho de tamaño, puede expandirse hacia la cavidad torácica.
¿Qué es el bocio difuso?
Se hace referencia al bocio difuso para denominar un tipo de bocio simple en el que se produce un aumento global del tejido tiroideo (sin la presencia de nódulos).
¿Qué es el bocio multinodular tóxico?
El bocio multinodular tóxico es un tipo de hipertiroidismo en el que se produce un aumento del tamaño del tiroides con formaciones nodulares (pequeños tumores) que realizan una producción elevada y anómala de las hormonas tiroideas.

Enfermedad
Anisakis
¿Qué es el Anisakis (Anisakiasis)?
El Anisakis o Anisakiasis es una enfermedad parasitaria causada por la ingesta de pescado crudo que contenga las larvas de un parásito llamado Anisakis simplex , el cual es un gusano de género nematodo, también conocido como gusano redondo. Mide hasta tres centímetros de largo y es blanquecino, y su ciclo vital afecta a los peces y mamíferos marinos, en los que puede producir lesiones en el tubo digestivo. Estas larvas se encuentran en los peces de mar y calamares .
La enfermedad se produce cuando se ingieren especies infectadas, crudas o poco cocidas, contaminadas por el gusano Anisado simplex, que parasita la pared gástrica y puede producir en el hombre una infección gastrointestinal o reacciones alérgicas. La mayor prevalencia se da en países como Japón, que tiene mayor consumo de pescado crudo asociado al sushi. En España se asocia al consumo de anchoas, sardinas, merluzas, etc . La incidencia va depender de la cantidad de pescado consumido, siendo mayor en las zonas costeras. La prevalencia en este país es de más del 40% de algunas especies que pueden estar contaminadas por anisakis y la población más afectada es la adulta. Es una patología poco común, en principio no es grave, pero si causa una reacción alérgica de tipo anafilaxia sí puede llegar a serlo.
Causas del Anisakis
En el ciclo vital del parásito los organismos adultos se encuentran en el estómago de los mamíferos marinos. Los huevos eliminados con las heces se incuban como larvas libres en el agua , estas, son ingeridas por los peces y calamares y lo primero que hace es cavar e intentar penetrar dentro de la mucosa del estómago o del intestino del pez. Cuando lo logran, se producen los síntomas típicos de la enfermedad.
El anisakis puede afectar al ser humano a través de dos procedimientos, que son:
Por hipersensibilidad inmediata mediada : implica que el parásito posee varios antígenos capaces de ocasionar indirectamente cuadros alérgicos, que van desde leves, como una simple urticaria, hasta graves como un shock anafiláctico.
El segundo tipo de mecanismo implica el efecto local del parásito sobre la pared del tubo digestivo.
Es transmitida por la ingesta de pescado crudo o insuficientemente cocinado contaminado por Anisakis simplex, que parasita la pared gástrica y ocasiona alteraciones digestivas. También, si previamente no se ha congelado el pescado al menos 72 horas antes del consumo a -20ºC , puede sobrevivir el parásito e infectar al consumidor. Los huéspedes definitivos son los mamíferos marinos, el hombre es un huésped accidental en el que se interrumpe el ciclo vital normal del parásito.
Síntomas del Anisakis
El Anisakiasis, puede producir dos tipos de cuadros dentro de 48 horas después de ingerir los alimentos contaminados, pero su patrón es variable. Estos se dividen en digestivos (anisakiasis gástrica) y alérgicos.
La anisakiasis gástrica se manifiesta con dolor abdominal intenso en la boca del estómago, náuseas y vómitos. El compromiso del intestino delgado provoca dolor abdominal inferior y signos de obstrucción. En algunas ocasiones puede confundirse con otros procesos como apendicitis (inflamación del apéndice), obligando en ocasiones a realizar una cirugía abdominal de urgencia.
También puede provocar reacciones alérgicas inmunoglobulina E (IgE) mediadas en personas sensibilizadas. Estas abarcan desde urticarias leves (prurito y lesiones cutáneas), hasta reacciones graves como anafilaxia y shock , lo que puede llegar a suponer un peligro vital. Es posible que la alergia no se produzca por ingestión del parásito, pero si con la exposición al alérgeno, que se da principalmente en pescadores y pescadores y que pueden sufrir otras afecciones como asma, rinoconjuntivitis o dermatitis por contacto.
Tratamiento del Anisakis
En el tratamiento de Anisakiasis, la mayoría de los pacientes mejoran sus síntomas de manera espontánea sin un tratamiento específico. Durante el periodo de molestias el tratamiento es sintomático. Fundamentalmente se utilizan fármacos llamados protectores gástricos (antiácidos) , que disminuyen la producción de ácido gástrico y evitan mayor daño mucoso.
Si el diagnóstico se realiza de forma precoz se puede proceder a extraer los gusanos de Anisakis por medio de una endoscopia. Si este se demora el parásito se introduce debajo de la mucosa intestinal y la extracción es muy difícil.
En caso de reacciones alérgicas, los corticoides y los antihistamínicos reducen la sintomatología. En reacciones anafilácticas graves es necesario usar adrenalina, ya que se trata de una situación de urgencia vital.
Pruebas complementarias del tratamiento del Anisakis
Las pruebas diagnósticas para la Anisakiasis, deben empezar por una evaluación médica con análisis de la historia clínica del paciente. Posteriormente se deben realizar análisis de sangre , aunque la enfermedad se puede diagnosticar directamente al ver el parásito en el tubo digestivo mediante una endoscopia.
Una radiografía de contraste también puede indicarse, para detectar si existe algún engrosamiento provocado por un edema (hinchazón) de la mucosa, que podría producir un estrechamiento en el intestino.
Además se realizan pruebas cutáneas de alergia para detectar la presencia de anticuerpo contra determinados antígenos. La prueba cutánea más conocida como Prick-test, que consiste en reproducir en la piel una reacción alérgica para determinar a qué sustancia es alérgico.
Factores de riesgo del Anisakis
El factor de riesgo principal en la infección por el consumo de las larvas del parásito Anisakis simplex, que puede provocar hipersensibilidad en la pared del intestino y reacciones alérgicas.
Complicaciones del Anisakis
En algunos casos la enfermedad por Anisakis puede producir complicaciones como:
Obstrucción intestinal.
Reacción alérgica grave (shock anafiláctico).
Prevención del Anisakis
Asegurarse de consumir pescado que haya sido congelado previamente.
Cocinar el pescado a más de 60ºC grados durante al menos 2 minutos, ya que algunas formas de hacerlo, como a la plancha suelen resultar insuficientes.
Evitar ingerir las partes del pescado que se encuentren cercanas al tubo digestivo.
Congelar el pescado al menos 72 horas antes de cocinarlo a -20º grados.
Evitar la ingesta de pescado crudo o poco cocinado.
No adquirir pescado que se comercialice dentro de cajas con agua y hielo.
Comprobar que el alimento esté en buenas condiciones como color, olor apropiados y aspecto agradable.
No olvidar que no es posible eliminar el Anisakis con vinagre.
Especialidades a las que pertenece el Anisakis
La especialidades médicas que tratan la anisakiasis son gastroenterología o digestivo, medicina interna y alergología.
Preguntas frecuentes:
¿Todos los pescados pueden tener Anisakis?
No todos los pescados pueden tener Anisakis, los de agua dulce están libres de este parásito, como son la trucha, la perca, etc. También los bivalvos como mejillones y almejas, porque su sistema de alimentación es distinto.
¿Cómo muere el Anisakis?
El Anisakis muere si el pescado que tiene el parásito se fríe, se hace al horno o se asa , o si se congela más de 24-48 horas a -20 grados antes de consumir.
¿Es peligroso comer Sushi?
Al comer Sushi, que es pescado crudo, se incrementa el riesgo de producir Anisakiasis si el pescado utilizado está infestado por el parásito y si la forma de preparación no cumple con los requisitos de sanidad.
¿Puede tener Anisakis el marisco?
Sí, los mariscos pueden tener Anisakis, los crustáceos, como langostinos, gambas, cangrejos y langosta, si no se consumen crudos o poco cocidos y tienen el parásito, también pueden causar la enfermedad.
Si cojo el Anisakis… ¿Ya no puedo comer pescado?
Sí puedes comer más pecados, si alguna vez a padecido la enfermedad lo importante es saber cómo tener el pescado en condiciones óptimas para el consumo , que es no comerlo crudo y congelarlo antes de consumirlo. Si ha tenido una reacción alérgica por Anisakis debe asegurarse con pruebas médicas y saber si puede comer pescados o derivados.

Enfermedad
Anorexia
¿Qué es la anorexia?
La anorexia o anorexia nerviosa es un trastorno de la alimentación que se caracteriza por el peso corporal anormalmente bajo , el temor intenso a aumentar de peso, y la percepción distorsionada del mismo. Para las personas con anorexia, es muy importante controlar su peso y su figura corporal. La anorexia es más frecuente en niñas y en mujeres. Sin embargo, cada vez más, los niños y los hombres presentan trastornos de la alimentación. La anorexia también es más frecuente en adolescentes, aunque se puede sufrir de anorexia a cualquier edad. La anorexia, al igual que otros trastornos de la alimentación, puede tomar el control de la vida de las personas y volverse muy difícil de sobrellevar . Pero con tratamiento, se puede lograr una mejor percepción de uno mismo, volver a tener hábitos de alimentación más saludables y revertir algunas de las complicaciones graves que causa la anorexia. Es una enfermedad común que si no se trata a tiempo puede llegar a ser grave.
Tipos de anorexia
Existen dos tipos de anorexia, estas son:
Anorexia nerviosa restrictiva : es el tipo de anorexia donde los pacientes logran un bajo peso a través de dietas muy restrictivas, ayuno muy prolongado y abundante ejercicio de intensidad elevada.
Anorexia nerviosa purgativa/compulsiva : es el tipo de anorexia en el que los pacientes recurren de forma puntual o sistemática a atracones o purgas (vómitos, laxantes, diuréticos…etc). Existen algunos pacientes que no presentan atracones pero sí recurren a la purga de forma sistemática.
Causas de la anorexia
No se conocen las causas exactas de la anorexia. Muchos factores probablemente estén involucrados y, al igual que otras muchas enfermedades, probablemente sea una combinación de factores biológicos, psicológicos y del entorno . Los genes y las hormonas pueden jugar un papel importante. Las actitudes sociales que promueven tipos de cuerpos muy delgados también pueden contribuir a su desarrollo.
El factor cultural es una de las causas principales de la anorexia. La cultura occidental moderna resalta la delgadez. El éxito y la valoración suelen estar equiparados con la delgadez. La presión de grupo puede ayudar a fomentar el deseo de estar delgado, especialmente en las mujeres jóvenes.
Existen factores biológicos que pueden causar la anorexia. Si bien aún no está claro qué genes están involucrados, podría haber cambios genéticos que hacen que algunas personas presenten un mayor riesgo de padecer anorexia. Algunas personas pueden tener una tendencia genética al perfeccionismo, la sensibilidad y la perseverancia, características vinculadas a la anorexia.
Síntomas de la anorexia
Los síntomas de la anorexia incluyen: pérdida excesiva de peso , aspecto pálido y ojos hundidos , piel y labios secos y quebradizos, retraso en el crecimiento, problemas hormonales, tener un miedo intenso de aumentar de peso o engordar incluso cuando su peso es insuficiente, tener una imagen corporal que está muy distorsionada, restringir estrictamente la ingesta de alimentos mediante las dietas o el ayuno, hacer ejercicio de forma excesiva, negar el hambre o poner excusas para no comer, saltar comidas o rehusarse a comer con frecuencia. Quejarse por estar gordo o tener partes del cuerpo que son gordas, piel amarillenta o manchada que está reseca y cubierta con un fino vello, depresión , sensibilidad extrema al frío, insomnio , disminución del interés en las relaciones sexuales, mentir sobre la cantidad de comida que se ingirió, retraimiento social, adoptar rituales rígidos para las comidas o la alimentación, como por ejemplo, escupir la comida después de masticarla, pigmentación azulada en los dedos de la mano, ausencia de menstruación, deshidratación, erosión dental y callosidades en los nudillos por la provocación de vómitos… etc.
Tratamiento de la anorexia
El mayor desafío en el tratamiento de la anorexia nerviosa es ayudar a la persona a reconocer que tiene una enfermedad. La mayoría de las personas que sufre este tipo de anorexia niega tener un trastorno alimentario y, con frecuencia, buscan tratamiento solo cuando su afección es grave.
El tratamiento para la anorexia suele llevarse a cabo mediante un abordaje en equipo, que incluye médicos, profesionales de salud mental y dietistas , todos con experiencia en trastornos de la alimentación. La terapia permanente y la educación sobre nutrición son muy importantes para la recuperación continua.
Los objetivos del tratamiento son, primero, restaurar el peso corporal normal y los hábitos alimentarios . Para comenzar, se puede recomendar una estancia corta en el hospital. Debido a la gran cantidad de complicaciones que causa la anorexia, tal vez se necesite controlar con frecuencia los signos vitales, el nivel de hidratación y electrolitos, además de otras afecciones físicas relacionadas. En los casos graves, es posible que las personas con anorexia primero necesiten recibir alimentación a través de un tubo que se coloca en la nariz y va hasta el estómago.
El tratamiento a menudo es muy arduo. Las personas afectadas y sus familias necesitan trabajar intensamente. Se pueden tratar muchas terapias hasta que el trastorno esté bajo control. La terapia individual cognitiva conductista (un tipo de psicoterapia), la terapia de grupo y la terapia de familia, han sido todas efectivas.
No hay medicamentos aprobados para tratar la anorexia porque ninguno ha demostrado funcionar bien. Sin embargo, los antidepresivos u otros medicamentos psiquiátricos pueden ayudar a tratar este trastorno.
Pruebas complementarias de la anorexia
Para el diagnóstico y tratamiento de la anorexia se inicia con una exploración física , consistente en medir la estatura y el peso, controlar los signos vitales, como la frecuencia cardíaca, la presión arterial y la temperatura, controlar la piel y las uñas para detectar problemas, escuchar el corazón y los pulmones, y examinar el abdomen. El médico para confirmar el diagnóstico puede solicitar: análisis de sangre, análisis de orina, una evaluación psicológica , radiografías, electrocardiogramas, pruebas de densidad ósea para buscar huesos delgados (osteoporosis), prueba de función renal, hepática, tiroidea… etc.
Factores desencadenantes del tratamiento de la anorexia
Entre los factores desencadenantes de la anorexia están la muerte o enfermedad de un ser querido, separación de los padres, fracasos escolares, rechazo social, accidentes, sucesos traumáticos, etc.
Factores de riesgo de la anorexia
Los factores de riesgo de la anorexia incluyen: tener un trastorno de ansiedad en la niñez, una imagen negativa de sí mismo, tener ciertas ideas culturales o sociales respecto de la salud y la belleza, estar más preocupado o prestarle más atención al peso y la figura, tratar de ser perfeccionista o demasiado centrado en reglas.
Complicaciones de la anorexia
La anorexia puede tener muchas complicaciones. En su forma más grave, puede ser mortal. Las complicaciones de la anorexia incluyen:
Anemia.
Problemas del corazón, como prolapso de la válvula mitral, ritmos cardíacos anormales o insuficiencia cardíaca.
Pérdida muscular.
Disminución de la masa ósea.
En los hombres, disminución de los niveles de testosterona.
Amenorrea (ausencia de menstruación).
Disminución en los glóbulos blancos que lleva al aumento del riesgo de infección.
Problemas de la glándula tiroides.
Falta de proteína, vitaminas, minerales u otros nutrientes importantes en el cuerpo.
Caries dentales.
Deshidratación grave.
Prevención de la anorexia
Para prevenir la anorexia es necesario:
Enseñar a los niños desde pequeños, tanto en casa como en la escuela, la importancia de unos correctos hábitos alimenticios.
Comer en familia siempre que sea posible.
Si la persona necesita perder peso por motivos de salud, debe hacerlo siempre bajo control médico y con el conocimiento de los padres.
Se debe evitar hacer comentarios despectivos sobre el aspecto físico de otras personas.
Potenciar la autoestima para que el joven pueda valorar sus cualidades y capacidades y no se avergüence de sus limitaciones.
Un ambiente familiar positivo.
Especialidades a las que pertenece la anorexia
La anorexia une varias ramas de la medicina, es decir, se necesita más de un especialista para tratarla. En la mayoría de los casos la anorexia es tratada por un médico general, un psicólogo y un nutricionista.
Preguntas frecuentes:
¿Qué es la anorexia purgativa?
Es un tipo de anorexia donde los pacientes recurren de forma puntual o sistemática a atracones o purgas (vómitos, laxantes o diuréticos). Existen algunos pacientes que no presentan atracones pero sí recurren a la purga de forma sistemática.
¿En qué se diferencia la anorexia de la bulimia?
La anorexia nerviosa se caracteriza por un miedo exagerado a engordar y por una distorsión de la imagen corporal, que hace que las personas que la padecen se vean y sientan gordas cuando no lo están. En el caso de la bulimia nerviosa, además del miedo a la gordura, existe un sentimiento de pérdida de control con la comida.
¿Es más frecuente la anorexia en mujeres que en hombres?
Sí, la anorexia es más común en mujeres que en hombres. Se estima que la anorexia es 10 veces más común que mujeres que en hombres.
¿Cuánto tarda una persona en curarse de la anorexia?
El tratamiento de la anorexia suele ser largo y difícil para la mayoría de los pacientes. El tiempo que tarda el tratamiento depende de la condición del estos.
¿Qué es la anorexia nerviosa restrictiva?
La anorexia nerviosa restrictiva es el tipo de anorexia donde los pacientes logran un bajo peso a través de dietas muy restrictivas , ayuno muy prolongado y abundante ejercicio de intensidad elevada.
Artículos por especialidad
CertificadosAlergologíaAnatomía PatológicaAnestesiología y ReanimaciónAngiología y Cirugía VascularAnálisis ClínicosAparato DigestivoCardiologíaChequeosCirugía General y del Aparato DigestivoCirugía General y del Aparato Digestivo PediátricaCirugía Oral y MaxilofacialCirugía Ortopédica y TraumatologíaCirugía Ortopédica y Traumatología PediátricaCirugía PediátricaCirugía Plástica y ReparadoraCirugía TorácicaClínica u HospitalDermatología Médico-Quirúrgica y VenereologíaEndocrinología y NutriciónEnfermeríaFisioterapiaGenética HumanaGinecología y ObstetriciaInmunologíaLogopedia y FoniatríaMedicina Estética y Unidad LaserMedicina Física y RehabilitaciónMedicina GeneralMedicina InternaMedicina NuclearMedicina del DeporteNefrologíaNeumologíaNeurocirugíaNeurofisiología ClínicaNeurologíaNutrición y DietéticaOdontología y EstomatologíaOftalmologíaOncología MédicaOncología RadioterápicaOsteopatíaOtorrinolaringologíaPediatríaPodologíaPoliclínicasPreparación al PartoPsicologíaPsiquiatríaRadiodiagnóstico-Diagnóstico Por ImagenReumatologíaTricologíaUnidad del DolorUrgencias HospitalariasUrología
Todas las especialidades  Savia
Savia