Artículos Especializados
Artículo especializado
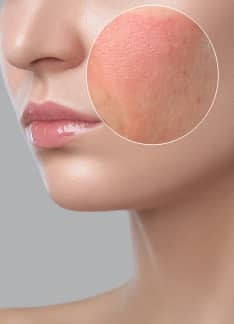
¿Qué es la rosácea en la cara y cómo tratarla?
La rosácea es un trastorno crónico de la piel que afecta sobre todo a la cara y se caracteriza por el enrojecimiento y la aparición de pápulas y pústulas. No tiene una cura definitiva, pero sí tratamientos efectivos.
¿Qué es la rosácea en la cara?
La rosácea es una enfermedad inflamatoria crónica de la piel que afecta predominantemente a la región central de la cara.
Entre los diferentes signos que la caracterizan se cuentan:
Rubor facial transitorio (flushing).
Eritema.
Telangiectasias (arañas vasculares).
Edema.
Pápulas y pústulas.
Lesiones oculares.
Fimas (engrosamiento cutáneo en zonas determinadas).
En la mayoría de los casos aparecen solo algunos signos.
La enfermedad puede afectar al 5 % de la población europea y suele hacer su aparición entre los 30 y los 50 años, aunque puede hacerlo a cualquier edad, incluso en la infancia. Afecta más a mujeres que a hombres, aunque estos suelen tener casos más severos.
La rosácea se encuentra entre las enfermedades dermatológicas que más afectan a la calidad de vida, debido a los sentimientos de vergüenza y ansiedad que provoca. La imagen corporal negativa que supone se relaciona en muchos casos con la aparición de síntomas depresivos.
Tipos de rosácea
La rosácea se clasifica en 4 tipologías, aunque en ocasiones se pueden solapar o coexistir:
Tipo 1: Rosácea eritematosa . Presenta un enrojecimiento facial característico que se exacerba periódicamente, localizado en la zona centrofacial de forma preferente. La piel aparece rosada y afecta negativamente a la calidad de vida de los pacientes y es difícil de controlar.
Tipo 2: Rosácea pápulo-pustulosa . Aparecen lesiones inflamatorias, pápulas y pústulas, que se pueden confundir con acné.
Tipo 3: Rosácea fimatosa . Puede producir un engrosamiento del tegumento cutáneo que da lugar a la aparición de “fimas”. La más frecuente es la que aparece en la nariz y suele afectar solo a los hombres. Se deben a una hiperplasia de las glándulas sebáceas y a la aparición de fibrosis.
Tipo 4: Rosácea ocular . Un 30-50 % de casos de rosácea presentan manifestaciones oculares, muy molestas y difíciles de tratar.
Qué causa la aparición de la rosácea
La causa de la rosácea es desconocida, aunque se conoce la existencia de una predisposición genética a padecer la enfermedad. También se ha demostrado la existencia de factores predisponentes y desencadenantes, como ciertos factores ambientales, alimentarios o emocionales.
Las principales anomalías que aparecen con la rosácea son el funcionamiento anómalo neurovascular y la alteración de la inmunidad innata.
De igual modo, se aprecia una alteración de la barrera cutánea y la presencia de microorganismos como Bacillus oleronius y el ácaro Demodex folliculorum.
Aunque se ha relacionado la rosácea con el sol, la radiación no es un factor causante de la enfermedad. Sí lo es el calor que puede producir esa radiación.
Otros factores que pueden desencadenar brotes de la enfermedad incluyen:
El frío.
El ejercicio intenso.
El estrés.
El alcohol.
Algunos medicamentos.
Las comidas calientes o picantes.
Cómo tratar la rosácea
La rosácea es tratable, pero no curable. No se puede hablar, por tanto, de un tratamiento único y curativo. El tratamiento deberá ser constante, extenderse a lo largo de los años y estar adaptado al tipo de rosácea y sus características individuales.
En el caso del tipo 1, el eritema facial (tanto el permanente como el transitorio o flushing ), puede ser controlado por un tratamiento tópico con agonistas alfa-2 adrenérgicos tópicos que inducen la vasoconstricción de los vasos cutáneos superficiales. También se pueden administrar betabloqueantes orales para el tratamiento del eritema transitorio ( flushing ).
Los láseres y fuentes de luz pulsada intensa pueden utilizarse también para el eritema no transitiro y son la opción principal para el tratamiento de las telangiectasias o arañas vasculares.
En el tipo 2, la primera línea de tratamiento para las lesiones inflamatorias leves incluye la ivermectina o metronidazol tópicos o doxiciclina oral.
En el tipo 3, las lesiones fimatosas con inflamación han mostrado la efectividad de doxiciclina, como isotretinoína oral. En el caso de las lesiones fimatosas sin inflamación o no activas, se deben utilizar terapias físicas, como el láser o la cirugía.
En el tipo 4, para tratar la afectación ocular puede ser suficiente el uso de tratamiento local oftalmológico, como corticoides tópicos, metronidazol y ciclosporina.
El dermatólogo decidirá el tratamiento más adecuado en función de las características del paciente y del posible solapamiento de los tipos de rosácea.
Consejos para pacientes con rosácea
Los consejos generales para los pacientes con rosácea incluyen:
Evitar los factores desencadenantes del rubor facial (climáticos, alimentarios, etc.).
Una higiene adecuada de forma regular no agresivas para la piel.
Aplicar de forma frecuente emolientes adecuados.
Utilizar fotoprotectores con índices de protección elevados (SPF 50).
Estas medidas son de especial relevancia para el control de los síntomas de la rosácea en la piel, especialmente la sequedad, el prurito y la sensación de quemazón.
Dr. Moisés Amselém
Especialista en Medicina Estética
El Doctor Moisés Amselem se ha convertido en una referencia mundial en el campo de la Medicina Estética.
Reserva ya tu videollamada
Bibliografía
Sociedad Española de Ginecología y Obstetricia. Alteraciones de la piel en el embarazo. Consultado: 24/08/2022.
Schepers C. Qué es el cloasma. Savia 2018. Consultado: 24/08/2022.
Guerra A. Embarazo y piel. Cambios fisiológicos y trastornos con repercusión estética. Actas Dermo-Sifiliográficas 2002; 93(2): 77-84.
Lee BW, Schwartz RA, Janniger CK. Melasma. G Ital Dermatol Venereol 2017; 152(1): 36-45. Doi: 10.23736/S0392-0488.16.05425-0.
Artículo especializado
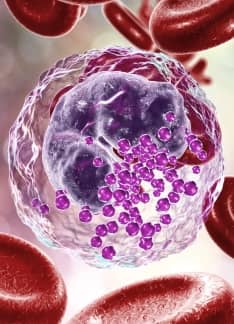
Basófilos altos o bajos: ¿Qué quieren decir?
Los glóbulos blancos o leucocitos son un tipo de células sanguíneas cuya función es defender al organismo frente a infecciones, agentes patógenos y células tumorales.
Existen varios tipos de leucocitos: linfocitos, monocitos, eosinófilos, neutrófilos y basófilos .
¿Qué son los basófilos?
Los basófilos son los leucocitos menos numerosos. Los valores normales de basófilos se sitúan en el 0-2 % de los glóbulos blancos y cuando están aumentados suele ser debido a la presencia de infecciones virales, tuberculosis o alergias. Junto con los eosinófilos y los neutrófilos forman parte del grupo de los granulocitos.
Se forman en la médula ósea y son liberados a la circulación sanguínea para actuar donde sean necesarios. Son activados como parte de la respuesta inflamatoria.
Los basófilos son las únicas células circulantes que contienen histamina. Comparten muchas similitudes con los mastocitos que están presentes en los diferentes tejidos.
Los basófilos son reclutados en los lugares donde existe inflamación y ahí pueden ser activados por diferentes moléculas, asociándose a patógenos o a la inmunoglobulina E (IgE). Al estimularse liberan su contenido histamínico, junto con otras sustancias inmunomoduladoras (citocinas, leucotrienos e histamina). De este modo, ayudan al sistema inmunitario. Los basófilos son especialmente relevantes en respuestas inmunitarias frente a parásitos.
Desde hace ya muchos años, los basófilos y mastocitos han sido implicados en la aparición de la enfermedad alérgica, ya que sus niveles plasmáticos se elevan ante la presencia de un cuadro clínico de alergia. Una vez que el antígeno accede y penetra en el organismo, estas células pueden rápidamente ser reclutadas en la piel, el pulmón o la mucosa nasal, por lo que se encuentran elevados en dermatitis atópica, asma, rinitis alérgica y pólipos nasales. Por lo tanto, los basófilos están implicados en la patogenia del inicio, desarrollo y cronicidad de las enfermedades alérgicas.
Basófilos altos
El aumento de basófilos por encima del rango normal se denomina basofilia. Se produce cuando se superan los 300 basófilos/ microlitro (µl) de sangre.
Suele ser habitual que aumente el número de basófilos ante la presencia de procesos inflamatorios crónicos y reacciones alérgicas.
De este modo, pueden aparecer en la inflamación crónica producida en el tracto gastrointestinal en el curso de patologías como la colitis ulcerosa.
Otras situaciones en las que se puede producir basofilia incluyen:
Artritis.
Insuficiencia renal.
Hipotiroidismo.
Procesos cancerosos como leucemia, mielofibrosis y policitemia.
Por lo general, la elevación del número de basófilos no causa síntomas, si bien en algunos casos puede cursar con fatiga, dolor abdominal, calambres, pérdida de peso inexplicable, fiebre y malestar.
Basófilos bajos
Los basófilos suponen el porcentaje más bajo dentro de los glóbulos blancos o leucocitos, llegando hasta el 2 % del total. Cuando su número desciende en exceso (basopenia), puede deberse en algunos casos a la presencia de determinadas afecciones o patologías. Suele ser poco habitual.
Se consideran cifras de basófilos bajos cuando aparecen en la analítica entre 0 y 20 /µl. En cualquier caso, como se ha señalado anteriormente, los niveles que se sitúan cerca de 0 (0-2% del total de leucocitos) se consideran normales. Cuando esta situación se reproduce en sucesivos análisis es cuando se hace necesario indagar en la causa.
Entre las causas que pueden provocar la disminución en el número de basófilos se cuentan:
Tirotoxicosis o crisis hipertiroidea.
Tratamiento con medicamentos que afectan al sistema inmune (como los corticoides).
Algunas infecciones.
La ovulación y el embarazo.
Situaciones de estrés.
Diferencia entre basófilos y eosinófilos
Los basófilos y eosinófilos forman parte de los leucocitos conocidos como granulocitos.
Los basófilos son un tipo de leucocito que tiene una función relevante en la protección inmunitaria y la reparación de heridas. Los basófilos constituyen la única célula circulante con capacidad para liberar histamina, sustancia involucrada en el proceso inflamatorio, y otros mediadores, siendo cruciales en el inicio de las reacciones alérgicas.
Por el contrario, los eosinófilos desempeñan otras funciones dentro del sistema inmunitario. Y aunque pueden estar elevados en cuadros alérgicos, la elevación de los eosinófilos puede estar relacionada con la existencia de una infección provocada por parásitos.
Por otro lado, los eosinófilos participan en la regulación del proceso inflamatorio. Ayudan a promover la inflamación, una de las primeras respuestas del organismo y del sistema inmune para aislar y controlar la zona en la que se ha localizado una infección o algún tipo de agresión en los tejidos.
Los eosinófilos también participan en procesos alérgicos y en la aparición de algunos de sus síntomas.
Finalmente, la disminución de basófilos en ocasiones puede estar asociada a la bajada de leucocitos eosinófilos (eosinopenia) por causa de una infección, tratamientos con corticosteroides o tratamiento hormonal frente al hipertiroidismo.
Artículo especializado
Volumen corpuscular medio: cómo interpretarlo
Los glóbulos rojos son las células sanguíneas encargadas de llevar el oxígeno desde los pulmones hasta todas las células del cuerpo. Cuando presentan un tamaño anómalo (son excesivamente grandes o pequeños), podría ser debido a un problema como la presencia de anemia o una deficiencia vitamínica, entre otros.
El volumen corpuscular medio es el parámetro que sirve para medir el tamaño de los glóbulos rojos.
¿Qué es el volumen corpuscular medio?
El volumen corpuscular medio (VCM) muestra el tamaño promedio de los glóbulos rojos o hematíes de la sangre. Se trata de un parámetro rutinario que forma parte del análisis encargado de analizar las células sanguíneas (hemograma).
Para calcularlo, se tiene en cuenta el hematocrito, es decir, el volumen que ocupan los glóbulos rojos dividido por y el número de glóbulos rojos. De este modo, expresa el volumen promedio de cada eritrocito.
Su cálculo permite identificar diferentes situaciones relacionadas con el tamaño de las células sanguíneas analizadas:
Normocitosis: tamaño del glóbulo rojo en rango normal.
Macrocitosis: tamaño del glóbulo rojo por encima de los valores normales.
Microcitosis: tamaño del glóbulo rojo por debajo de los valores normales.
El VCM en análisis de sangre puede servir junto a otras pruebas para indagar sobre algunos trastornos de la sangre, como los diferentes tipos de anemia .
Existen muchos tipos de anemia. Su causa más común es el déficit de hierro, esencial para producir hemoglobina, que es la proteína de los glóbulos rojos encargada de captar y transportar el oxígeno desde los pulmones al resto de tejidos del organismo.
Algunas patologías y condiciones que pueden causar anemia incluyen el embarazo, las menstruaciones muy abundantes, un consumo insuficiente de hierro con la dieta, deficiencias dietéticas de ciertas vitaminas como el ácido fólico o la vitamina B12, algunas enfermedades hereditarias, etc.
En cuanto a los valores del VCM, estos deben considerarse siempre junto a los datos del historial médico de cada paciente y teniendo en cuenta sus características personales. No siempre que estos están fuera de los límites normales significa que pueda existir una patología o un trastorno de salud. Elementos como la dieta, la actividad física, el tratamiento con algunos medicamentos o la menstruación, entre otros factores, pueden afectar a los resultados.
Alteraciones del volumen corpuscular medio
Cuando la determinación del volumen corpuscular medio señala que los glóbulos rojos son más pequeños de lo normal (VCM bajo) podría deberse a las siguientes causas:
Ciertos tipos de anemia, incluyendo anemia por deficiencia de hierro o anemia ferropénica, el tipo de anemia más habitual.
Talasemia, un trastorno genético que impide la producción normal de hemoglobina.
Patologías reumáticas.
Tratamiento con algunos medicamentos (algunos antituberculosos e inmunosupresores, entre otros).
Cuando la determinación del volumen corpuscular medio señala que los glóbulos rojos son más grandes de lo normal (VCM alto) podría deberse a las siguientes causas:
Anemia perniciosa (por falta de vitamina B12 o problemas que impidan su utilización, como ciertos trastornos inmunitarios, enfermedad celiaca o enfermedad de Crohn).
Anemia causada por falta de ácido fólico.
Patologías hepáticas.
Alcoholismo.
Hipotiroidismo.
Tratamientos con medicamentos quimioterápicos o antivirales.
Por otro lado, también se pueden dar casos de anemia con un volumen corpuscular medio dentro de la normalidad. Esta situación puede estar propiciada por:
Pérdida abundante de sangre (por ejemplo, por una hemorragia).
Insuficiencia renal.
Anemia aplásica (la médula ósea no produce suficientes glóbulos rojos).
¿Qué pueden diagnosticar los distintos valores del VCM?
Como se ha dicho, el volumen corpuscular medio (VCM) indica el tamaño de los glóbulos rojos. Los valores normales o de referencia se sitúan entre los 80 y los 100 fl (femto litros) en adultos. Los niños de 6 a 12 años presentan un VCM algo menor (86 fl) y los de 12 a 18 de 88 fl.
Valores por debajo de lo normal pueden indicar, entre otros, un déficit de hierro, una pérdida sanguínea abundante (por la menstruación o pérdidas digestivas, por ejemplo) o una talasemia, que es una anomalía genética de la hemoglobina.
Valores más elevados pueden ocurrir si hay un déficit de vitamina B12 o de ácido fólico.
Para el diagnóstico de la anemia se tienen en cuenta otros parámetros además del VCM como los valores de hemoglobina y de hemoglobina corpuscular media (HCM).
Dependiendo de las características de estos tres parámetros, se pueden diagnosticar diferentes tipos de anemia, según la combinación siguiente:
VCM y HCM bajo . Indica anemia microcítica.
VCM y HCM normales . Indica anemia normocítica.
VCM y HCM alto . Indica anemia macrocítica.
A partir del resultado del análisis del hemograma, el médico podrá solicitar otros exámenes que puedan confirmar el diagnóstico de la anemia.

Artículo especializado
El melasma en el embarazo: ¿Por qué ocurre?
Uno de los efectos que tiene el embarazo sobre la piel es el melasma, un aumento de pigmentación de origen hormonal.
¿Qué es el melasma gestacional?
Se define como melasma (o cloasma) a la aparición de manchas en la piel en la zona del rostro.
Se trata de manchas por aumento de producción de melanina en la epidermis y la dermis. Suelen aparecer durante el embarazo (entre el cuarto y el sexto mes) debido a los cambios hormonales que acompañan a esta situación. También suelen aparecer en el transcurso del tratamiento con anticonceptivos orales.
Se estima que hasta un 75 % de las mujeres embarazadas experimentará algún tipo de melasma gestacional.
Las manchas son de color marrón, asimétricas y de tamaño variable. Se sitúan en zonas con exposición a la luz como la frente, el bigote o los pómulos, si bien pueden aparecer también en los antebrazos, el escote o la espalda.
Causas del melasma en el embarazo
Las causas del melasma no son del todo conocidas, si bien parecen confluir diversos elementos en su aparición, incluyendo:
Factores genéticos.
Hormonales.
Vasculares.
Inmunológicos.
E inflamatorios.
También pueden participar factores como la exposición a radiación ultravioleta, algunos medicamentos y ciertos cosméticos.
Los estrógenos femeninos aumenta la producción de melanina en la piel, siendo además estimulada por la radiación ultravioleta solar, que suele suponer la persistencia del cuadro después del parto.
Afecta más a las mujeres de piel morena, y cuando aparece a lo largo de un embarazo es más probable que vuelva a aparecer en embarazos posteriores.
Por otro lado, la exposición prolongada a la luz azul de las pantallas, en personas con predisposición, también puede ser causa de aparición de melasmas.
Cómo evitar el melasma en el embarazo
Las lesiones por hiperpigmentación no son fáciles de tratar. Para ello, se recomienda evitar los factores desencadenantes, en este caso la exposición al sol sin fotoprotección, además del uso de agentes tópicos despigmentantes.
Para el melasma del embarazo el tratamiento puede incluir diferentes despigmentantes tópicos como acido azelaico, alfahidroxiácidos como el ácido glicólico u otros agentes como antioxidantes tópicos. Es muy importante evitar durante el embarazo principios activos como el retinol o la hidroquinona.
En todos los casos es importante evitar tratamientos agresivos que causen inflamación ya que podrían empeorar las manchas. Muchas veces es conveniente realizar una combinación de tratamientos debido a la frecuencia con la que se producen recurrencias en este tipo de patología de la piel.
Finalmente, deberá ser el Dermatólogo el que determine el tratamiento más adecuado y valore la conveniencia de comenzarlo después del embarazo.
Consejos para prevenir el melasma gestacional
Cuando se establece un tratamiento para el melasma es muy importante la fotoprotección, evitando el sol directo y usando protectores para los rayos ultravioleta A y B, durante y después del tratamiento.
De este modo, para la prevención del melasma, se pueden recomendar algunas actuaciones:
Evitar la incidencia directa del sol o los sistemas lumínicos que inducen un aumento de las lesiones.
Utilizar filtros solares de alta protección, tanto en verano como en invierno. Si no se utilizan cremas fotoprotectoras una vez que el melasma ha aparecido, las probabilidades de que sea resistente al tratamiento y se cronifique son elevadas.
Evitar cosméticos irritantes. Además, es frecuente que algunos cosméticos sufran una activación cuando se exponen al sol, pudiendo provocar una reacción inflamatoria en la piel.
Para solucionar los problemas de pigmentación como el melasma es recomendable consultar con un Dermatólogo .
Dr. Gustavo Guillermo Garriga Martina
Especialidad: Dermatólogo especialista en melasma, acné de la mujer adulta y rosácea.
Dermatólogo en Hospital Universitario Virgen de la Victoria de Málaga. Profesor en Máster de Medicina Estética de la Universidad de Málaga. Consulta privada presencial en Málaga capital y online para toda España.
Reserva ya tu videollamada
Bibliografía
Sociedad Española de Ginecología y Obstetricia. Alteraciones de la piel en el embarazo. Consultado: 24/08/2022.
Schepers C. Qué es el cloasma. Savia 2018. Consultado: 24/08/2022.
Guerra A. Embarazo y piel. Cambios fisiológicos y trastornos con repercusión estética. Actas Dermo-Sifiliográficas 2002; 93(2): 77-84.
Lee BW, Schwartz RA, Janniger CK. Melasma. G Ital Dermatol Venereol 2017; 152(1): 36-45. Doi: 10.23736/S0392-0488.16.05425-0.

Artículo especializado
Evita el acné: Mejores consejos y recomendaciones
El acné puede definirse como un problema exclusivamente dermatológico. Sin embargo, dependiendo de su gravedad, también puede tener repercusiones psicológicas y emocionales.
¿Por qué se produce el acné?
El acné es una inflamación de los folículos sebáceos de la piel que produce diferentes tipos de lesiones. Se caracteriza por la aparición de pústulas, comedones, pápulas y nódulos, o dicho de forma más simple, granos y espinillas.
El acné suele aparecer en la cara, cuello, pecho, espalda y hombros, y es más común entre los adolescentes. Si se tienen en cuenta incluso las formas más leves, se podría decir que casi todos los adolescentes se enfrentan al acné en algún momento. También afecta a personas en etapas posteriores de la vida.
Factores que contribuyen al desarrollo del acné
No se conocen del todo bien las causas que provocan la aparición del acné. Se especula que los cambios hormonales de la pubertad pueden estar en su origen. De este modo, el aumento de andrógenos (hormonas masculinas como la testosterona) fomenta la producción de sebo y esta sobreproducción obstruye los folículos pilosos. Ahí entran en escena diversas bacterias, especialmente Propionibacterium acnes , normalmente inocua, pero en este caso se multiplica y produce inflamación.
También existen otros factores como la genética y la alimentación que podrían influir en la aparición del acné.
Consejos para evitar el acné en la cara
Entre los factores modificables para evitar el acné, se podrían citar:
Mantener una buena higiene facial para minimizar la obstrucción de los folículos sebáceos.
Mantener una dieta rica en alimentos vegetales y controlada en azúcares, productos refinados y lácteos.
En cuanto al resto de factores, como el hormonal, es difícil poder controlarlos.
Por lo que respecta al tratamiento, una vez que el acné ya ha hecho su aparición, existe una gran diversidad de ellos:
Cosméticos de uso tópico (geles, lociones, cremas y jabones).
Medicamentos, de uso tópico o por vía oral.
Otros procedimientos, incluyendo la exfoliación, la dermoabrasión y los tratamientos con láser. Estos tratamientos también pueden ayudar a reducir las cicatrices del acné.
Los tratamientos basados en medicamentos suelen ser efectivos, aunque lentos. Los resultados empiezan a notarse al cabo de un par de meses.
Para el acné leve puede bastar un producto tópico a base de retinoides , derivados de la vitamina A. También es efectivo el peróxido de benzoilo , y el ácido azelaico que ayuda a desbloquear los poros y tiene propiedades antimicrobianas y antiinflamatorias . Los efectos no deseados de estos tratamientos tópicos son sequedad, irritación y descamación de la piel.
Para tratar el acné moderado se usan combinaciones de fármacos tópicos con antibióticos orales y tópicos.
En los casos de acné severo , los dermatólogos incluyen tratamientos con isotretinoína . Se trata de un medicamento oral bastante eficaz, pero que presenta numerosos efectos adversos.
También se puede utilizar otro tratamiento para las mujeres a base de anticonceptivos orales. Estos medicamentos ayudan a reducir la producción hormonal de andrógenos, responsables del aumento de la producción del sebo.
Cuidados de la piel con acné
La piel con acné requiere de un cuidado especial, desde la higiene, la hidratación y el maquillaje.
La higiene de la piel con acné es importante llevarla a cabo con cuidado. No es cierto el mito de que conviene lavarse la cara varias veces al día. Con dos veces al día es suficiente.
Productos de limpieza facial para el acné
Los productos de limpieza facial deben conseguir eliminar la suciedad de la piel, pero respetando al máximo los lípidos cutáneos y sin irritar.
Los jabones tradicionales en pastillas y geles detergentes son buenos limpiadores, pero resultan agresivos y mal toleradas para cualquier tipo de piel.
Como alternativa existen los syndets (synthetic detergents) o “jabones sin jabón”. Presentan poder detergente y espumante, propiedades dispersantes, emulsivas y humectantes y un pH ácido que se corresponde con el pH fisiológico de la piel. Pueden presentarse tanto en forma de panes dermatológicos como en forma de jabones líquidos.
También existen emulsiones y geles limpiadores que resultan eficaces y a la vez muy poco agresivos.
Lo recomendable es usarlos por la mañana y por la noche, con agua tibia y sin frotar con demasiada fuerza. Para secar la piel tampoco hay que frotar, sino dar suaves toques con la toalla sin arrastrar.
Hidratación de la piel con acné
Un elemento importante para la piel con acné es la hidratación. Los productos para este tipo de piel suelen llevar activos queratolíticos o exfoliantes y otros ingredientes como el zinc. Normalmente se eligen en textura de gel o crema ligera, que no aporte grasa a la piel.
Cómo evitar el acné hormonal
El objetivo principal del tratamiento del acné, especialmente en mujeres que han superado la pubertad, es controlar y tratar las lesiones existentes, prevenir en la medida de lo posible la aparición de cicatrices, limitar la duración del trastorno y minimizar sus efectos.
Si existen trastornos hormonales, el tratamiento respectivo podrá contribuir a normalizar las afecciones de la piel, incluido el acné.
El tratamiento con anticonceptivos orales puede ayudar a reducir la producción hormonal de andrógenos, responsables del aumento de la producción del sebo.
Tratamientos tópicos
El tratamiento tópico suele ser utilizado en los casos más leves, incluyendo principios activos como el peróxido de benzoilo , ácido azelaico , los retinoides y algunos antibióticos.
Los antibióticos tópicos como la eritromicina y la clindamicina no deberían usarse en monoterapia por la aparición de frecuentes resistencias bacterianas.
El gel de nicotinamida ha demostrado ser eficaz en pacientes mayores, presentando un efecto antiinflamatorio y sin promover resistencias bacterianas.
Tratamientos sistémicos
Antibióticos sistémicos . En pacientes adultas la respuesta suele ser lenta y en muchos casos ineficaz.
Tratamiento hormonal . Es eficaz en todos los casos, tanto si existe hiperandrogenismo como si no. Hay que tener en cuenta el mayor riesgo de tromboembolismo en mujeres maduras. Los antiandrógenos junto con anticonceptivos orales están indicados en mujeres con trastornos hormonales.
También existen terapias no farmacológicas que incluyen la extracción de puntos negros y blancos con o sin infiltración, la exfoliación, la terapia con luz pulsada, la terapia con láser, la fotodinámica y la terapia por calor.
Tratamientos adyuvantes
En las lesiones nodulares o quísticas inflamadas se pueden usar corticoides para la reducción del riesgo de cicatrices y disminución del dolor y la inflamación de forma rápida.
Las lesiones nodulares inflamadas con frecuencia dejan como secuela hiperpigmentación que se puede mejorar con retinoides tópicos o ácido azelaico.
Si existen macro comedones se pueden considerar las terapias físicas como peelings con ácido glicólico o con frío.
Dr. Jesús Martínez Rubio
Especialista en Dermatología
Número de Colegiado: 161602612
Me gradué en Medicina en la Universidad Autónoma de Madrid, hice la residencia vía MIR en dermatología en el Hospital Ramón y Cajal de Madrid, fui Jefe Clínico de Dermatología del Hospital La Zarzuela de Madrid hasta 1996, y actualmente compagino la actividad pública en la Unidad de láser dermatológico del Hospital Ramón y Cajal de Madrid, con la actividad privada asistencial y docente.
Mis áreas de interés es el láser dermatológico, tratamiento de cicatrices con láser, acné vulgar y acné rosácea, alopecias y uso terapéutico sistemas de láser y luz optimizada.
Reserva ya tu videollamada
Artículo especializado
RDW alto o bajo: descubre qué es y qué significa
Los análisis de sangre actuales incluyen parámetros nuevos que el laboratorio de hematología ha incorporado en su rutina. Uno de ellos es el RDW.
¿Qué es el RDW?
El Red Blood Cell Distribution Widht (RDW) o Amplitud de la Distribución Eritrocitaria representa el coeficiente de variación de tamaño de los glóbulos rojos en sangre. Este es el reflejo de la anisocitosis o diferencia de tamaño de los glóbulos rojos. Se trata de una prueba cuyo valor que se expresa en porcentaje y que, normalmente, viene incluida dentro del hemograma.
En una muestra de sangre normal siempre existe un grado de anisocitosis: los glóbulos rojos más jóvenes presentan un volumen mayor que los glóbulos rojos más maduros. De este modo, el RDW permite observar de manera gráfica cuando coexisten en una muestra dos poblaciones de glóbulos rojos de diferentes tamaños.
Una de las posibles utilidades de la RDW es observar su modificación en el contexto evolutivo de una anemia en tratamiento, ya que puede ayudar a tener una visión de la producción de células sanguíneas que se está produciendo en un momento dado.
Si bien el RDW se suele incluir de manera rutinaria dentro del hemograma en una analítica normal, sería pertinente disponer de este parámetro en situaciones que incluyan los siguientes síntomas o situaciones del paciente:
Debilidad, mareos, palidez y síntomas compatibles con estados de anemia.
Antecedentes familiares de trastornos hereditarios de la sangre, como talasemia o anemia falciforme, entre otros.
Patologías crónicas como diabetes, enfermedad de Crohn o infección por VIH.
Dietas deficientes o carenciales (especialmente con bajos niveles de ingesta de hierro y vitaminas del grupo B).
Hemorragias o pérdidas de sangre recientes.
Valores normales del RDW
Los valores normales de RDW se sitúan entre un 11% y un 15%.
RDW alto
Un RDW alto es indicativo de que los glóbulos rojos presentan un tamaño superior a lo normal. Esta situación puede estar causada por una destrucción excesiva de eritrocitos o por unos niveles disminuidos en su producción.
Un valor de RDW alto permite distinguir entre los diferentes tipos de anemia. Para ello puede ser útil tener información de otros parámetros como los niveles de hemoglobina y el volumen corpuscular medio (VCM).
Las causas más frecuentes de un valor de RDW alto en mujeres y en hombres incluyen:
Anemia ferropénica. Aparecen valores ligeramente elevados de RDW junto con niveles disminuidos de hemoglobina y VCM.
Anemias megaloblásticas (por niveles disminuidos de vitamina B9 o vitamina B12). Aparece una anisocitosis moderada, junto con hemoglobina baja y un VCM elevado.
Anemia hemolítica. Se trata de una patología que causa la disminución de los glóbulos rojos que acortan su vida.
Se trata de un grupo de patologías hereditarias que cursan con una producción alterada de hemoglobina.
Patologías hepáticas.
Personas en tratamiento de quimioterapia.
La normalización de los valores de RDW requiere el tratamiento de la enfermedad que lo provoca. En este sentido, cuando se inicia el tratamiento para corregir los diferentes tipos de anemia, los valores de RDW pueden sobrepasar el 30%. Esto suele ser una señal de respuesta positiva al tratamiento.
RDW bajo
Un valor de RDW bajo, en general no tiene significado clínico. Simplemente refleja una gran similitud en el tamaño de los glóbulos rojos. Si el resto de los parámetros del análisis están dentro de la normalidad no es necesario preocuparse.
Un RDW bajo se debe considerar junto con otros parámetros, como el volumen corpuscular medio (VCM).
Por el contrario, cuando también está alterado el Volumen Corpuscular Medio (VCM), el RDW bajo puede indicar la presencia de enfermedades crónicas como patologías del hígado, problemas renales, VIH, cáncer o diabetes.
Finalmente, aunque la RDW es un valor utilizado dentro del hemograma para distinguir los diferentes tipos de anemia, también puede ser útil para conocer la evolución en pacientes que presentan insuficiencia cardíaca. Así, hay estudios que vinculan el nivel de RDW alto y depresión en pacientes con problemas cardiacos.
Artículo especializado
Neutrófilos: valores normales
Los glóbulos blancos o leucocitos son un tipo de células sanguíneas cuya función es defender al organismo frente a infecciones, agentes patógenos y células tumorales.
Existen varios tipos de leucocitos: linfocitos, monocitos, eosinófilos, basófilos y neutrófilos .
¿Qué son los neutrófilos?
Los neutrófilos son el tipo de leucocitos o glóbulos blancos más abundantes.
Se caracterizan por la forma multilobulada de su núcleo y por acudir en primer lugar a los puntos de inflamación aguda en respuesta a señales que producen las células dañadas y células del sistema inmunitario. De este modo, los neutrófilos constituyen una gran proporción del infiltrado celular temprano en los tejidos con inflamación, siendo el mayor componente del exudado purulento.
Los neutrófilos constituyen la primera línea de defensa frente a microorganismos invasores. Utilizan estrategias como la fagocitosis de patógenos y la liberación de factores antimicrobianos.
También es un tipo de célula capaz de estimular la respuesta de otras células inmunitarias.
La participación de los neutrófilos permite crear un entorno antimicrobiano en el lugar en el que se ha producido la inflamación, que contribuye a la muerte de los patógenos.
Valoración de neutrófilos
A partir de un análisis de sangre o hemograma completo , se puede valorar el número de las diferentes células que componen la sangre. Es una prueba muy útil en caso de situaciones clínicas de infección y enfermedades crónicas.
¿Qué valores de neutrófilos son normales?
Los valores de neutrófilos normales se sitúan en torno a 2.000-7.500/mL, suponiendo un 45-75 % del total de leucocitos. Aunque en los estudios analíticos podemos estudiar su número absoluto, es frecuente estudiar su número relativo en relación con el resto de la celularidad sanguínea.
Dentro de las causas más habituales de su incremento se sitúan las infecciones bacterianas.
Neutrofilia
La neutrofilia o aumento en el recuento absoluto de neutrófilos (valores por encima de 8.000/ml), se observa con mayor frecuencia en procesos infecciosos bacterianos agudos.
El número de neutrófilos también puede aumentar en presencia de ciertas agresiones a nuestro organismo como fracturas, quemaduras o en el posoperatorio de muchos pacientes.
El número elevado de neutrófilos puede no causar síntomas, aunque sí la situación aguda que lo está provocando.
Existen otras enfermedades crónicas que también cursan con neutrofilia como procesos inflamatorios crónicos y trastornos autoinmunitarios como la artritis reumatoide.
Otras situaciones en las que se pueden observar unos niveles elevados de neutrófilos incluyen:
Cuadros inflamatorios no infecciosos, como colagenopatías.
Condiciones de estrés.
Eclampsia en mujeres embarazadas.
Artritis reumatoide e hiperuricemia (gota).
Enfermedades del tiroides.
Leucemia.
La realización de ejercicio intenso.
Situaciones de hipoxia.
Por causa del consumo de algunos medicamentos como corticoides, adrenalina, entre otros.
Tabaquismo.
La neutrofilia propia de patologías hematológicas como síndromes mieloproliferativos crónicos se acompaña de alteración en los recuentos de las otras células y características morfológicas especiales.
Cuando se descubre un número de neutrófilos por encima de lo normal y no hay una razón evidente, como una infección, se analiza una muestra de sangre al microscopio para determinar si existe una fuga de neutrófilos inmaduros (mieloblastos) de la médula ósea hacia la sangre. La presencia de neutrófilos inmaduros en la sangre puede indicar un trastorno medular, como la leucemia.
En cualquier caso, en condiciones normales la neutrofilia no provoca síntomas por sí misma.
Tipos de neutropenia: neutrófilos bajos y sus causas
Se entiende como neutropenia a la disminución en el recuento absoluto de neutrófilos por debajo de 1.500/ml. Se considera neutropenia severa un recuento absoluto por debajo de 500/ml.
La neutropenia puede determinar una mayor vulnerabilidad ante las infecciones. Cuando la neutropenia es grave, las bacterias normales pueden causar enfermedades serias.
La causa más habitual es la provocada por el consumo de fármacos, entre ellos:
Quimioterápicos.
Antiinflamatorios no esteroideos.
Antiepilépticos.
Psicofármacos.
Algunos antibióticos.
Otras causas de disminución en recuento de neutrófilos incluyen:
Anemia aplásica.
Radioterapia o exposición a la radiación.
Infecciones de origen viral.
Infección bacteriana grave.
Carencias vitamínicas.
En algunas infecciones virales como la gripe, la hepatitis y el VIH se pueden observar neutropenias severas.
Artículo especializado
Diferencia entre TAC y Resonancia
En algunas ocasiones, para completar el estudio y llegar al diagnóstico de una patología es necesario realizar pruebas de imagen. Algunas de ellas son la tomografía axial computarizada (TAC) y la resonancia magnética .
¿Qué es el TAC?
La tomografía axial computarizada , TAC o escáner es una prueba diagnóstica por imagen en la que se utilizan rayos X sobre las áreas del cuerpo a estudiar. Posteriormente, toda la información obtenida es recogida por un ordenador que las ensambla para generar imágenes detalladas de diferentes planos o cortes de la zona de interés, permitiendo reconstrucciones anatómicas multiplanaes y tridimensionales.
Mediante las imágenes de un TAC se pueden analizar diferentes estructuras del organismo, aportando una gran resolución anatómica. Permite el estudio de diferentes partes del cuerpo y detectar enfermedades:
Cerebro: infecciones, tumores, accidentes cerebrovasculares y fracturas.
Aparato digestivo: tumores, infecciones y obstrucción intestinal.
Aparato urinario: litiasis, infecciones y tumores.
Aparato musculo esquelético: Tumores y fracturas.
Pulmones: neumonía, trombos, enfermedades pulmonares y tumores.
Hoy en día, esta técnica permite confirmar muchos de los diagnósticos que se llevan a cabo.
Debido a la utilización de rayos X, la radiación ionizante es el elemento que limita el uso del TAC. La dosis que utiliza es muy superior a la de una radiografía. La radiación se acumula y puede causar daño en los tejidos a largo plazo.
Preparación y explicación de la prueba
No es necesario ir en ayunas a no ser que se precise un estudio con contraste.
Se trata de una prueba no invasiva e indolora.
La máquina es circular como una rosquilla. El paciente debe tumbarse sobre la mesa del TAC. Debe estar tranquilo y quieto durante la prueba. Suele durar unos 20 minutos, dependiendo de la zona anatómica a estudiar.
A veces se necesita utilizar contraste intravenoso para visualizar mejor las imágenes o para un estudio concreto.
Es necesario informar cuando se está embarazada o dando lactancia, si tiene alergia al contraste o padece diabetes o asma.
¿Qué es la resonancia magnética?
La resonancia magnética es una técnica de diagnóstico basada en la imagen que utiliza un potente imán y ondas de radiofrecuencia muy altas para obtener imágenes de la zona anatómica a estudio. Estas imágenes oportunamente tratadas por un programa informático son analizadas por un médico radiólogo. De este modo, se obtiene información muy detallada y específica de la región corporal estudiada. El informe de la resonancia se entregará al médico solicitante que junto con el resto de información clínica hará un diagnóstico.
Se trata de una prueba no invasiva que no utiliza rayos X.
La resonancia nos informa sobre detalles de los órganos, vasos y tejidos músculo-esqueléticos, existiendo diferentes tipos en función de la zona que se quiere estudiar:
Resonancia magnética de huesos y articulaciones. Permite el estudio de la anatomía musculo esquelética y detectar infecciones, tumores, lesiones de ligamentos y músculos, fracturas óseas, etc.
Resonancia magnética de mama. Permite junto con la mamografía y ecografía mamaria estudiar tumores en las mamas.
Resonancia magnética del cerebro y medula espinal. Permite estudiar accidentes cerebrovasculares, tumores, esclerosis múltiple, hemorragias, lesiones en ojos, oído, etc.
Resonancia magnética de órganos internos. Permite el estudio de hígado, páncreas, bazo, riñones, ovarios, próstata, etc.
Resonancia magnética del corazón y sus vasos. Permite estudiar la estructura y función del corazón y así diagnosticar enfermedades del sistema cardiovascular.
Está indicada para estudio de diferentes enfermedades y en personas que no pueden realizarse TAC por ser alérgicas a los contrastes que utilizan.
Preparación y explicación de la prueba
Antes de la prueba hay que quitarse todos los objetos metálicos (joyas, relojes, dentadura, audífonos, etc.).
Es necesario avisar si es portador de marcapasos cardíaco, electrodos cardiacos o cerebrales, grapas usadas en las cirugías de los aneurismas, desfibrilador automático implantable, implantes cocleares y cualquier fragmento u objeto metálico introducido por accidente o cirugía en el organismo.
No es necesario acudir en ayunas, salvo que la prueba se realice con contraste.
Al comenzar la prueba el paciente se tumbará en una mesa que se moverá y le desplazará al interior de la máquina, que es como una especie de túnel. Se escucharán unos ruidos que darán fe del funcionamiento del aparato. La prueba suele durar entre 30 y 60 minutos.
En algunas ocasiones por problemas de claustrofobia, ansiedad o uso pediátrico es necesario realizar la prueba con sedación. También existen aparatos abiertos para personas con obesidad o para personas que por diferentes motivos no toleran la prueba cerrada.
Se debe informar al médico si se está embarazada o lactando, se padece insuficiencia renal grave, alergia al contraste o se ha sido trasplantado de hígado.
Principales diferencias entre TAC y RM
Una de las principales diferencias entre el TAC y la RM es que la segunda no utiliza rayos X y, por lo tanto, no presenta los efectos adversos de la radiación .
La duración de la exploración por TAC es menor que la que la resonancia.
El TAC no hace apenas ruido y es más abierto, por lo que no genera los problemas de claustrofobia y ansiedad de la resonancia, que es como un tubo alargado y más ruidoso.
Los equipos para realizar la resonancia son más caros que el TAC.
En el TAC no existen los problemas con los objetos metálicos como en la resonancia.
En definitiva, la resonancia magnética y el TAC son pruebas que facilitan el diagnóstico de diversas patologías, mediante distintas técnicas no invasivas. Cada una de estas pruebas tiene unas indicaciones específicas y debe ser el médico el que decida cuál es la más adecuada en función de la sospecha clínica y las características del paciente.

Artículo especializado
Rinorrea: ¿Qué es y qué la provoca?
La rinorrea o goteo nasal es un síntoma que puede tener su causa en diferentes afecciones y patologías.
¿Qué es la rinorrea?
El término rinorrea describe cuando existe un aumento significativo de secreción nasal. Es uno de los síntomas más habituales por el que los pacientes consultan al médico. La manera en la que aparece y sus características (de forma aguda o crónica, constante o intermitente, el color, el olor, la consistencia, etc.) pueden servir para delimitar sus causas.
La rinorrea puede ser anterior, la secreción sale por agujeros nasales; o posterior, drena por la garganta.
Dependiendo de la duración puede ser aguda o crónica.
La secreción puede ser serosa, mucosa, purulenta o sanguinolenta.
Puede afectar a una fosa nasal (unilateral) o ambas fosas nasales (bilateral).
¿Qué causa la rinorrea?
En condiciones normales, la nariz y los senos paranasales producen mucosidad que mantiene la nariz húmeda para compensar la sequedad causada por la respiración. Hay muchas afecciones y patologías que pueden provocar que la nariz aumente su secreción nasal. Las causas más habituales de la rinorrea incluyen:
Infecciones víricas y bacteriana.
La mucosidad puede producirse por alergias ante diferentes alérgenos (polen, polvo, alimentos, etc.).
Rinitis no alérgica. El aumento de mucosidad puede ser el resultad
o de una reacción ante agentes irritantes como el humo o la contaminación.
Pólipos nasales.
Infecciones de los senos paranasales y/o de las adenoides.
Cuando se llora, una parte de las lágrimas fluyen por los conductos lagrimales hacia la cavidad nasal.
Frío. Las bajas temperaturas pueden provocar una reacción que genera un aumento de mucosidad.
Cuerpo extraño en las fosas nasales.
Desviación del tabique nasal. Los dos lados de la nariz están separados por una pared de hueso y cartílago. En ocasiones, el tabique puede estar inclinado hacia un lado lo que provoca la obstrucción en ese lado. Esta deformidad puede estar presente al nacer o ser resultado de un traumatismo en la nariz.
Quistes o tumores nasales .
En ocasiones se puede producir rinolicuorrea, que es la salida de líquido cefalorraquídeo por una o ambas fosas nasales. Se sospecha cuando existe un traumatismo o cirugía reciente.
Estudio de la rinorrea
Lo primero que hay que realizar es una historia clínica detallada:
Desencadenantes y duración.
Tipo de rinorrea: unilateral o bilateral, olor, color.
Síntomas acompañantes: prurito, cefalea, pérdida de audición, picor ocular, tos, dolor de oído, fiebre.
Antecedentes personales: historia de alergias, hábitos tóxicos, traumatismo o cirugía nasal, exposición laboral ambiental, uso de medicamentos, asma, dermatitis, etc.
El médico le realizará una exploración física detallada en función de la sospecha clínica.
El paciente será remitido al especialista de otorrinolaringología u otro especialista si existen síntomas de alarma, no mejora con los tratamientos o existen complicaciones.
Pruebas complementarias
No es lo habitual, pero en ocasiones es necesario solicitar pruebas complementarias.
El especialista en otorrinolaringología realiza una nasofaringolaringoscopia para la exploración directa de estructuras nasales.
A veces hay que hacer otras pruebas como estudio de alergias, TAC de senos paranasales o resonancia magnética.
¿Cuándo se trata la rinorrea?
Una vez que se determina el origen del aumento de secreción nasal, el tratamiento dependerá del origen y causa de la rinorrea.
En caso de rinitis alérgicas se utiliza tratamiento farmacológico con antihistamínicos y corticoides nasales. En ocasiones el alergólogo puede pautar inmunoterapia.
Si se sospecha causa bacteriana se utilizan antibióticos.
Cuando existen pólipos nasales que no mejoran con tratamiento farmacológico, existen quistes o tumores, puede ser necesario el tratamiento quirúrgico.
¿Cuándo preocuparse por la rinorrea?
A menudo la rinorrea desaparece sola.
Cuando persiste o va acompañada de otras dolencias, la secreción nasal puede ser un síntoma de otras enfermedades.
Cuando la rinorrea se prolonga en el tiempo, la irritación y obstrucción nasal pueden afectar a la calidad de vida del paciente.
El médico de familia realizará una historia clínica completa y una exploración física para orientar el diagnóstico y pautar un tratamiento adecuado. Si no mejora, existen datos de alarma o sospecha de complicaciones, se derivará al otorrinolaringólogo, alergólogo o especialista pertinente para llevar a cabo los estudios complementarios necesarios.
Los casos en los que la causa de la rinorrea no está claro o se producen complicaciones deben ser analizados por el especialista en Otorrinolaringología .

Artículo especializado
Cuerpo lúteo: ¿Qué es y cuándo se forma?
El ciclo menstrual dura de media 28 días, si bien existen diferencias entre mujeres y la duración puede variar con la edad.
Este ciclo se divide en varias fases, que incluyen el sangrado o menstruación, seguida de la fase folicular en la que se desarrolla el futuro óvulo, la ovulación y finalmente el cuerpo lúteo , que antecede a un nuevo sangrado o menstruación.
¿Qué es el cuerpo lúteo?
El cuerpo lúteo es el tejido formado después de que el óvulo sea liberado desde el folículo ovárico. Una de sus principales funciones es la producción de progesterona para el potencial establecimiento y mantenimiento de la gestación.
Cuando se libera la hormona folículo estimulante (FSH) en el cerebro, en el ovario se comienzan a desarrollar folículos, en cuyo interior se forman los óvulos. El folículo dominante conseguirá alcanzar un mayor desarrollo frente al resto de folículos, liberando el óvulo en ese ciclo menstrual. Además, los folículos se encargan de liberar estradiol que provocará en el útero el engrosamiento del endometrio.
Una vez que la ovulación ha tenido lugar, el folículo que lo contenía se transforma en cuerpo lúteo (también conocido como cuerpo amarillo).
La doble función del cuerpo lúteo incluye el mantenimiento de la actividad menstrual en los ciclos en los que no hay fecundación y, cuando esta sí tiene lugar, promueve la liberación de sustancias endocrinas que permiten la iniciación y el avance de la gestación.
¿Cuándo se forma el cuerpo lúteo?
Tras la ovulación se inicia la fase lútea, en la que se desarrolla el cuerpo lúteo. Esta fase se extiende aproximadamente desde el día 15 al 28 del ciclo menstrual.
El cuerpo lúteo perdurará hasta que se produzca una posible fecundación del óvulo o tenga lugar la menstruación, con el comienzo de un nuevo ciclo menstrual.
Tras la ovulación, el folículo va disminuyendo de tamaño mientras sigue produciendo progesterona y estrógenos que preparan al útero para recibir a un posible embrión.
Tras la liberación del óvulo por el cuerpo lúteo, este se dirige hasta el útero a través de la trompa de Falopio. Cuando se produce la fecundación del óvulo, el embrión se implanta una semana después de la fecundación. En ese momento el organismo comienza a producir la gonadotropina coriónica humana (hCG) encargada de mantener el folículo activo en su producción de estrógenos y progesterona. Con ello se evitará que se desprenda el revestimiento del útero, formándose y madurando la placenta donde tendrá lugar la mayor parte del embarazo.
Por el contrario, si no tiene lugar la fecundación, el folículo se va contrayendo lo que determina una disminución de los niveles de estrógenos y progesterona. Esto dará lugar a que el revestimiento del útero se desprenda y se produzca la hemorragia de la menstruación.
¿Qué hormona se produce en el cuerpo lúteo?
Como se ha dicho, el cuerpo lúteo secreta progesterona y estrógenos. Cuando se produce la fecundación del óvulo el cuerpo amarillo se hace más grande y su producción de hormonas se incrementa para sustentar el embarazo. Cuando la fecundación no tiene lugar, encoge y degenera, disminuyendo su producción hormonal.
¿Cuánto tiempo dura el cuerpo lúteo?
La fase lútea tiene una duración de 14 días que puede fluctuar en 2 días más o menos. Después de la ovulación, la estructura folicular que queda en el ovario convirtiéndose en el cuerpo lúteo, asume su función de glándula liberadora de hormonas. La vida del cuerpo lúteo hace que su degeneración a los 14 días determine el fin del ciclo menstrual. De este modo, al final de la fase lútea los niveles de progesterona y estrógeno disminuyen, dando lugar a la menstruación.
Por otro lado, aunque el día más común de la ovulación es el día 15 del ciclo menstrual (que en muchos casos no dura 28 días), el momento de la ovulación también puede presentar una gran variabilidad en el tiempo. Además, la duración de la fase lútea puede variar dentro de una misma mujer de un ciclo a otro. De este modo, una mujer puede ovular en un día del ciclo diferente en cada ciclo y, de igual modo, entrar en la fase lútea también en días diferentes.
Artículo especializado
PH vaginal: cómo regularlo
Las infecciones vulvovaginales son un motivo muy frecuente de consulta médica, estimándose que el 75% de las mujeres experimentan un episodio de vulvovaginitis a lo largo de su vida. Uno de los principales factores relacionados es el pH vaginal.
¿Qué es el pH vaginal?
El pH es un parámetro que indica el grado de acidez-alcalinidad de un medio y su valor puede oscilar entre 0 (máxima acidez) y 14 (máxima alcalinidad). En la vagina el pH óptimo (o la acidez vaginal) se sitúa entre 3,5 y 4,5. Sin embargo, se trata de un valor que puede experimentar variaciones en función de diferentes factores, incluyendo la edad de la mujer, el embarazo, la menopausia o cuando se producen infecciones.
¿Cuál es la función del pH vaginal?
El pH vaginal adecuado ayuda a mantener sana la mucosa vaginal y proteger frente a posibles infecciones.
En condiciones normales, existe una colonia de microorganismos en la vagina que constituye su microbiota o flora natural. Cuando el pH vaginal se desequilibra se puede dar lugar a la proliferación de microorganismos patógenos que causen infecciones y dolencias. En la flora vaginal normal abundan los lactobacilos, un tipo de bacterias que se caracterizan por su efecto protector frente a diferentes agentes patógenos.
De este modo, cuando tiene lugar un pH vaginal alterado la población de lactobacilos se puede ver desplazada junto con su efecto protector. Esta situación puede dar lugar a la aparición de patologías infecciosas a nivel vaginal como las candidiasis, la vaginosis bacteriana y la tricomoniasis.
Microbiota vaginal normal: la importancia de los lactobacilos
La alteración de la microbiota vaginal es la causa principal de las infecciones vaginales.
La microbiota vaginal es el conjunto de microorganismos que habitan de manera natural y sin causar daño en la región vaginal. Su composición cambia notablemente con la edad, dependiendo de las variaciones en los niveles de estrógenos.
De este modo, cuando aparecen los ciclos menstruales, el epitelio vaginal aumenta su grosor, segregando un exudado que contiene glucógeno y otros nutrientes. Este hecho facilita la colonización principalmente de lactobacilos, pero también de otras bacterias como Gardnerella vaginalis y hongos como Candida albicans . En un momento determinado estos microorganismos pueden convertirse en patógenos si proliferan en exceso o se produce una modificación en el pH vaginal.
Los lactobacilos son los principales garantes del mantenimiento del ecosistema vaginal, promoviendo mecanismos como:
Competición con los hongos por los nutrientes disponibles.
Bloqueo de receptores epiteliales para los hongos.
Potenciación de la respuesta inmune.
Generación de sustancias capaces de producir ácido láctico a partir de la glucosa (peróxido de hidrógeno, lactacinas y acidolinas). El ácido láctico es el responsable de mantener el pH vaginal en rangos entre 3,5 y 4,5. Este constituye el principal mecanismo de defensa frente a la colonización por patógenos.
Los lactobacillus metabolizan el glucógeno secretado por las células más superficiales de la mucosa vaginal y, de esta forma, contribuyen a mantener unos niveles de pH adecuados. Cuando tiene lugar la menopausia, se produce una disminución, incluso desaparición, de la capa de células superficiales, dando lugar a una disminución en la presencia de Lactobacillus, alteraciones en el pH y a la proliferación de microorganismos patógenos.
¿Qué valores de pH vaginal son normales?
A lo largo de la vida de una mujer el pH vaginal va experimentando una evolución que determina diferentes valores de normalidad. De este modo, durante la infancia y hasta la pubertad el pH de la vagina es neutro (cercano a 7). Posteriormente, el aumento de estrógenos y la instauración de la microbiota normal durante la edad reproductiva determinan una disminución de los valores de pH (entre 3,5 y 4,5). Finalmente, tras la menopausia el pH vaginal vuelve a la neutralidad.
Regular el pH vaginal puede contribuir a evitar infecciones y la aparición de síntomas molestos como irritación, picor, enrojecimiento y sequedad.
Síntomas del desequilibrio del pH vaginal
Como se ha dicho, el desequilibrio del pH vaginal puede dar lugar a la modificación de la flora vaginal y a la posible proliferación de microorganismos patógenos. Esto puede ir asociado a síntomas de mayor o menor intensidad entre los que se encuentran:
Modificaciones del flujo vaginal (cambios de color, olor y consistencia).
Picor y escozor.
Sequedad vaginal.
Molestias al orinar.
Molestias durante las relaciones sexuales.
Ante la aparición de estos síntomas es recomendable consultar con un especialista en Ginecología y Obstetricia.
Factores que pueden alterar el pH vaginal
El equilibrio del pH vaginal depende de una serie de factores, algunos de los cuales pueden ser controlados de forma individual modificando ciertos hábitos. Entre estos factores se encuentran:
Higiene vaginal . En ocasiones la utilización de jabones agresivos puede irritar el interior de la vagina, modificando el pH. Esto contribuye a destruir la flora vaginal normal y propiciando la proliferación de microorganismos patógenos.
Productos perfumados . Ciertas sustancias aromáticas presentes en compresas, papel higiénico, etc., no son adecuados para mantener un pH vaginal normal.
Tratamiento con antibióticos . Los antibióticos utilizados de forma prolongada o frecuente pueden afectar negativamente a la flora vaginal.
Por otro lado, la gestación, la lactancia o la menopausia son etapas en la vida de la mujer en las que, debido a las variaciones hormonales características de cada una de ellas, pueden tener lugar alteraciones en el pH vaginal.
Consecuencias del desequilibrio del pH vaginal
La vulvovaginitis es la inflamación de la mucosa vaginal y de la piel vulvar. La vulvovaginitis causada por el hongo Candida es la más prevalente, aunque también pueden producirse infecciones por bacterias.
La vulvovaginitis candidiásica es una enfermedad inflamatoria de la vagina, producida por diferentes especies de hongos, fundamentalmente de Candida −siendo la más frecuente dentro de esta especie la Candida Albicans − que tiene lugar en condiciones fisiológicas alteradas con disminución de la inmunidad local. Se trata de un proceso muy común en las mujeres adultas, con un pico máximo de incidencia entre los 20 y 40 años. Se calcula que, a los 25 años el 50% de las mujeres habrá tenido al menos un episodio. De igual modo, entre las mujeres premenopáusicas el 75% habrá sufrido al menos un episodio y el 45% dos episodios o más de vulvovaginitis candidiásica.
Las alteraciones en la inmunidad leves que se producen previas a tener la menstruación también pueden favorecer la aparición de candidiasis vaginal.
Por otro lado, las vaginosis bacterianas son menos frecuentes y se caracterizan por un incremento de la secreción vaginal, que se hace más acuosa y maloliente, y que se acompaña de escasa sintomatología adicional. El mal olor de este flujo se suele poner más de manifiesto cuando entra en contacto con fluidos de pH alcalino (como el semen, la sangre menstrual y el gel empleado en exploraciones ginecológicas, entre otros).
También se puede producir una inflamación vulvar o vaginal de origen irritativo o alérgico que no esté causada por ningún microorganismo. Estas suelen estar relacionadas con la utilización de jabones o cremas irritantes, el empleo de ropa interior de tejidos sintéticos y al uso frecuente de protectores (compresas, salvaslips, pañales, etc.).
Artículo especializado
Hormona hcg: ¿Qué es y cuál es su función en el embarazo?
La hormona gonadotropina coriónica humana (u hormona hCG por sus siglas en inglés) es una hormona que se produce exclusivamente durante el embarazo.
¿Qué es la hormona hcg?
La hormona hCG es una glucoproteína que es liberada por el embrión cuando este se implanta en el útero materno. De este modo, la hCG también es conocida como “hormona del embarazo” y sirve para confirmar que la fecundación ha tenido lugar y se da inicio al embarazo.
La hormona hCG está formada por dos subunidades o fracciones:
Alfa-hCG . Se trata de una parte común a otras hormonas como la TSH (hormona estimulante de la tiroides), la FSH (hormona folículo estimulante) o la LH (hormona luteinizante).
Beta-hCG . Es exclusiva de la hormona hCG y es la que se utiliza en los test de embarazo.
A la hormona hCG se le atribuyen algunos síntomas característicos del embarazo , como las náuseas y los vómitos. Durante el primer trimestre de la gestación tiene lugar el mayor aumento de la hormona, por lo que es en ese periodo cuando suelen aparecer más los síntomas. La hCG también se relaciona con otros síntomas como el cansancio y la sensación de sueño, la irritabilidad, los problemas gastrointestinales y los cambios de humor.
Utilidad clínica de la determinación de hCG
La determinación de la hCG en la orina y la sangre es de gran utilidad clínica en el diagnóstico del embarazo normal, pero también de sus patologías, como el embarazo ectópico, embarazo anembrionado y la muerte del embrión.
También puede ser útil en la detección de trisomías, determinadas patologías gestacionales, tumores ováricos, en la inducción médica de la ovulación y el control de la fertilidad, entre otras situaciones.
¿Cuántos mUI/ml debo tener para estar embarazada?
La hormona hCG está presente en el organismo de la mujer durante toda la gestación, si bien sus valores varían conforme evoluciona el embarazo.
Durante el primer trimestre del embarazo la hCG aumenta hasta llegar a un pico de concentración máxima en la semana 12-14 de gestación.
La hormona coriónica humana en el embarazo normal incrementa sus valores en las primeras semanas de una manera casi constante, duplicando su valor cada 48 horas. Sus concentraciones en orina y sangre se correlacionan muy bien con la cantidad de tejido que envuelve y protege al embrión (el trofoblasto). De este modo, los niveles de hCG permiten el seguimiento del embarazo en sus primeras fases.
En los embarazos ectópicos o extrauterinos, en los que existe poco tejido trofoblástico, los niveles en sangre y orina de la hormona serán más bajos.
Por el contrario, las elevadas concentraciones de hCG por encima de los valores normales pueden hacer sospechar de la presencia de un embarazo múltiple.
La combinación de ultrasonografía transvaginal, junto con la determinación cuantitativa de hCG puede ayudar a establecer, de forma temprana, diagnósticos sobre las gestaciones ectópicas.
Los intervalos orientativos de referencia para la hormona hCG en sangre en función de las semanas de embarazo se pueden cifrar en:
3 semanas de embarazo: de 5 a 50 mUI/ml.
4 semanas: entre 5 y 130 mUI/ml.
5 semanas: entre 75 y 7.000 mUI/ml.
6 semanas: entre 1.080 y 56.500 mUI/ml.
Entre 7 y 8 semanas: entre 7.650 y 229.000 mUI/ml.
Entre 9 y 12 semanas: entre 25.700 y 288.000 mUI/ml.
Entre 13 y 16 semanas: entre 13.300 y 254.000 mUI/ml.
Entre 17 y 24 semanas: entre 4.060 y 165.400 mUI/ml.
Entre 25 y 40 semanas: entre 3.640 y 117.000 mUI/ml.
En cualquier caso, las concentraciones de hCG en suero y orina varían sustancialmente durante el embarazo y entre diferentes mujeres.
¿Cómo se detecta la hormona gonadotropina coriónica?
Las pruebas de embarazo (o prueba hCG) están basadas en la detección de la fracción beta de la hCG. Estas pueden ser realizadas en orina o en sangre. Pueden distinguirse dos tipos de pruebas:
Test de embarazo cuantitativos . Señalan los niveles exactos de la hormona en la sangre materna. Estas pruebas permiten establecer unos valores de referencia según las semanas de gestación.
Test de embarazo cualitativos . Indican la presencia o ausencia de la hormona en sangre o en orina y, por tanto, la existencia o no de embarazo.
Cuando se desea saber la existencia o no del embarazo, lo ideal es esperar para realizar el test de embarazo hasta el primer retraso de la menstruación o 15 días después de haberse producido la relación sexual.
Para hacer la prueba de embarazo con resultados fiables en el transcurso de un tratamiento de reproducción asistida, se recomienda esperar unos 10-15 días desde la transferencia embrionaria o la inseminación artificial.
¿Cómo produce la hormona gonadotropina coriónica?
La hormona gonadotropina coriónica humana (hCG) es una proteína sintetizada principalmente por los tejidos embrionarios.
Su secreción se relaciona con la cantidad de tejido trofoblástico que envuelve el embrión desde la semana 4 a la 20 de embarazo. A partir de la semana 20 los niveles se relacionan con el peso del feto.

Artículo especializado
Absceso mamario: ¿Qué es y cómo tratarlo?
Los efectos beneficiosos de la lactancia materna en la salud de la madre y el bebé son ampliamente conocidos, recomendándose de manera exclusiva durante los seis primeros meses de vida y su continuación durante los siguientes meses de vida del bebé. Sin embargo, muchas mujeres dejan de amamantar debido a la mastitis y los problemas derivados de la aparición de abscesos mamarios.
¿Qué es el absceso mamario?
Cuando se produce una mastitis o inflamación del tejido mamario, esta puede estar asociada a un proceso infeccioso que suele coincidir con el periodo de lactancia.
En estas circunstancias también puede tener lugar la aparición de un absceso en el pecho o absceso mamario , consistente en una acumulación de líquido infectado o pus en el tejido mamario. En la mayoría de las ocasiones, este se origina por una mastitis que no ha sido tratada a tiempo o no de manera adecuada. El absceso mamario suele ser una acumulación localizada. Las principales bacterias causantes de los abscesos suelen ser de tipo anaerobio que necesitan un medio sin oxígeno para sobrevivir.
Por otro lado, un absceso de mama sin lactancia es aquel que tienen lugar cuando la mujer que lo padece no está amamantando o en periodo de embarazo.
Habitualmente los abscesos se tratan con antibióticos, incisión y drenaje o aspiración del líquido por medio de una aguja guiada por ecografía.
Los abscesos mamarios son un importante problema para la salud de la mujer, con tendencia a ser recurrentes. Un factor de riesgo importante para la recurrencia es que la mujer sea fumadora. Además, pueden dejar secuelas permanentes, como deformidades en la mama o la disminución de la capacidad de producir leche.
¿Por qué se produce el absceso mamario?
La mayor parte de los abscesos mamarios suelen ser consecuencia de una complicación cuando se produce una mastitis o inflamación de la mama. Esta tiene lugar generalmente por una infección bacteriana que afecta al seno.
La mastitis no es exclusiva de las mujeres lactantes, pero suele relacionarse con el periodo en el que la madre amamanta a su hijo.
Infecciones bacterianas
La mayoría de los abscesos mamarios tienen su causa en una infección de origen bacteriano.
Las bacterias causantes de la infección pueden acceder al interior de la mama a través de pequeñas roturas o grietas que se producen en el pezón producidas debido a la fricción de la lactancia.
También pueden proliferar en los conductos mamarios cuando la leche se acumula y se queda estancada por la obstaculización de un conducto. Ocasionalmente, la infección puede producirse por vía hematógena.
La proliferación bacteriana que se produce es respondida por el sistema inmunitario, creándose un pequeño acúmulo de bacterias y leucocitos muertos (pus). De este modo, el objetivo es contener la infección y reducirla a una localización, intentando evitar de esta forma la diseminación a otros lugares del organismo.
El microorganismo más frecuentemente implicado en el absceso mamario es el Staphylococcus aureus , seguido por Staphylococcus epidermidis .
Factores de riesgo
La aparición de abscesos mamarios suele darse con mayor frecuencia en determinadas circunstancias:
En mujeres durante su primer embarazo.
Edad de la madre superior a los 30 años.
Gestaciones largas.
Obesidad o diabetes de la madre.
Mujeres que trabajan fuera del hogar.
Mujeres fumadoras.
Si existen antecedentes de mastitis.
Cómo detectar el absceso mamario
El absceso mamario resulta muy perjudicial durante la lactancia, aunque a veces es difícil de detectar. La incidencia del absceso mamario como complicación de una mastitis se estima entre el 3 y el 11%.
Este debe sospecharse en caso de progresión de una mastitis o infección mamaria y persistencia de una zona bien definida con los siguientes síntomas, a pesar de que ya pueda existir un tratamiento en curso:
Enrojecimiento
Dolor fluctuante.
Fiebre
Ganglios linfáticos aumentados.
El signo más característico del absceso es la aparición de una induración que resulta fluctuante al tacto. Pero no siempre está presente, sobre todo en abscesos localizados en regiones profundas no accesibles a la exploración física mediante palpación.
De este modo, la detección de los abscesos mamarios también puede estar condicionada a su localización. Esta puede ser:
Superficial . La zona afectada coincidente con la de máximo enrojecimiento.
Profunda . La localización interna determina la aparición tardía de los síntomas inflamatorios, con un mayor retraso en el diagnóstico, lo que puede provocar un mayor tamaño del absceso y una mayor destrucción de tejidos mamarios.
Diagnóstico del absceso mamario
El diagnóstico está basado en los síntomas y signos. Si es necesario se pueden utilizar pruebas complementarias como la ecografía y la punción con aspiración por medio de aguja fina.
La ecografía puede servir para diferenciar la mastitis difusa y el absceso mamario localizado.
Finalmente, el cultivo de la leche materna es esencial para el correcto diagnóstico microbiológico y el establecimiento del tratamiento más adecuado.
¿Qué hacer si tenemos un absceso mamario?
Ante la presencia de síntomas de mastitis o absceso mamario es fundamental acudir al ginecólogo.
Si se confirma la presencia de un absceso, el tratamiento se basará en el drenaje y la administración de antibióticos. La selección de los medicamentos antibióticos específicos para los abscesos mamarios debe estar dirigida a las bacterias que con más frecuencia producen estas infecciones y en función de los resultados del cultivo de la leche materna. Ayudará a establecer un tratamiento antibiótico efectivo la realización de un antibiograma para establecer las resistencias específicas de los microorganismos desarrolladas frente a los diferentes fármacos.
Medidas preventivas
Para la prevención de la aparición de abscesos es preciso asegurar un adecuado vaciamiento del pecho para evitar el estancamiento de la leche en los conductos mamarios y tratar de forma precoz el llenado excesivo de las mamas (ingurgitación mamaria), así como las grietas en los pezones y el bloqueo de los conductos mamarios.
Algunos consejos que pueden ser útiles incluyen:
Ofrecer el pecho a demanda sin límites en la duración de la toma.
Extracción de la leche restante tras la toma si el vaciado no ha sido completo.
Evitar la compresión de la mama (por ejemplo, con el uso de ropa ajustada).
Procurar un descanso materno adecuado.
Medidas de higiene de manos de la mujer y las personas que puedan contactar con la mama.
Tratamiento precoz de las grietas infectadas en la mama con antibióticos de uso tópico. La mejor prevención para la aparición de grietas en la mama es una correcta técnica de lactancia. Por tanto, es muy importante el asesoramiento y el acompañamiento por personal especializado en esta etapa.
También es importante una adecuada educación materna en el ámbito de la lactancia, incluyendo aspectos como:
Correcta extracción de la leche.
Exploración de la mama con identificación de ingurgitación, estasis e inflamación mamaria.
Ante cualquier duda sobre la presencia de infección o absceso mamario es preciso consultar con el especialista en Ginecología y Obstetricia.

Artículo especializado
Cómo subir las defensas de tu cuerpo
¿Quieres saber cómo subir las defensas de tu organismo? Te mostramos qué alimentos, hábitos y estilos de vida ayudan a tener un sistema inmune fortalecido.
El sistema inmunológico es el responsable de defender a nuestro organismo frente a agentes patógenos. Está compuesto por una red de órganos, tejidos y células. Las células NK, los linfocitos T y B, los neutrófilos y macrófagos son algunas de las células inmunitarias. Nuestro organismo cuenta con mecanismos de inmunidad innata (barreras que no permiten la entrada de agentes nocivos al cuerpo) y adquirida (se desarrolla cuando el cuerpo está expuesto a varios antígenos y construye una defensa específica para diferentes patógenos o moléculas).
La expresión “tener las defensas bajas” hace referencia a un estado debilitado del sistema inmunológico. Ante esta situación, aumenta la vulnerabilidad del cuerpo frente a infecciones.
Alimentos que suben las defensas
Los nutrientes de la dieta juegan un rol esencial en el mantenimiento óptimo de la respuesta inmune. Un estado de nutrición deficiente compromete los mecanismos de defensa del organismo.
Para aumentar las defensas es recomendable asegurar la ingesta de:
Verduras . Especialmente aquellas de hoja verde y verduras de la familia de las crucíferas (brócoli, coliflor, col rizada o kale, coles de Bruselas, etc.).
Fruta fresca . En especial cítricos, por su contenido en vitamina C, la cual, además, tiene propiedades antioxidantes.
Proteína. Mejor que sea magra y de calidad para preservar la masa muscular. Por ejemplo, pollo, pavo, conejo y pescado. En cambio, es importante reducir el consumo de carnes rojas y procesadas. La pérdida de masa muscular se ha asociado a mayor susceptibilidad de padecer diferentes enfermedades.
Probióticos. Los microorganismos vivos tales como bacterias o levaduras, que proporcionan beneficios para la salud. Se encuentran en alimentos fermentados como el yogur, kéfir, kimchi, etc. Su consumo contribuye a una mejora de la microbiota intestinal.
Alimentos ricos en fibra como vegetales, hortalizas, frutas, legumbres, frutos secos y semillas.
Alimentos ricos en betacarotenos . Por ejemplo, calabaza, zanahoria, boniato, mango, etc. Los betacarotenos son precursores de la vitamina A, la cual está implicada en la modulación de la respuesta inmune.
Frutos secos (como las nueces de Brasil y pipas de calabaza). Con 2 o 3 nueces de Brasil podemos conseguir cubrir los requerimientos de selenio diarios, metal implicado en diversos encimas de acción inmunitaria.
Cómo reforzar el sistema inmune rápidamente
Se puede fortalecer el sistema inmune y mejorar las defensas con una dieta equilibrada . Cobran importancia micronutrientes como las vitaminas A, C y D, algunas vitaminas del grupo B, el zinc y el selenio.
Más allá de la alimentación, no debemos descuidar unos hábitos de estilo de vida saludables, los cuales también juegan un papel importante.
Hábitos para subir las defensas
Evitar el estrés con el fin de evitar una elevación permanente de cortisol.
Mantener un peso saludable . Una ingesta deficiente o excesiva puede comportar consecuencias negativas para el sistema inmune.
Realizar actividad física moderada de forma habitual. Practicar ejercicio ayuda mantener un sistema inmunitario más eficiente, además de eliminar bacterias de las vías respiratorias, así como a regular el estrés.
Tener un sueño de calidad. El sueño y el sistema inmunitario están vinculados de forma bidireccional. La falta de sueño se ha asociado a la debilitación de la respuesta inmunitaria y a la reducción de la producción de anticuerpos.
Evitar el tabaco y el alcohol. Su consumo debilita el sistema inmune y aumenta el riesgo de padecer múltiples enfermedades.
No automedicarse. Limitar la toma de medicamentos a la prescripción médica. Abusar de algunos fármacos como los antibióticos , puede alterar nuestra respuesta inmune.
Distribuir la ingesta en 2 o 3 comidas diarias, evitando picotear entre horas. Ceñirse a las comidas principales es una costumbre saludable.
Limitar las horas de ingesta asegurando un ayuno de 12 a 16h. El ayuno promueve la regeneración celular (autofagia) y reduce indicadores de inflamación. La autofagia comporta múltiples beneficios para nuestra salud, entre ellos, el de combatir patógenos invasores.
Evitar comer por la noche. Hábitos como cenar tarde, las recenas, despertarse por la noche y comer de madrugada, suelen desestabilizar nuestros ritmos circadianos .
Exponerse al sol de 5 a 15 minutos diarios para conseguir unos niveles adecuados de vitamina D . El déficit de vitamina D está asociado con un mayor riesgo de varias enfermedades, ya que esta vitamina está implicada en el correcto desarrollo de los limfocitos T.
Cómo saber si tengo las defensas bajas
Existen algunos signos y síntomas que pueden estar relacionadas con el hecho de tener las defensas bajas:
Sensación frecuente de cansancio y fatiga.
Caída del cabello repentina o abundante.
Tener infecciones de forma recurrente (herpes, otitis, infección urinaria, etc.).
Cicatrización lenta de los tejidos.
En las analíticas de sangre aparecen los valores de concentración de varios elementos celulares en sangre, el hemograma . Nos da información acerca de los valores de varias células del sistema inmunológico responsables de defender al organismo de elementos patógenos. Los niveles de linfocitos, neutrófilos, monocitos y eosinófilos, entre otros, pueden revelarnos el estado de nuestras defensas.
En situaciones de defensas bajas se podrán establecer diferentes estrategias de inmunoterapia .
Artículo especializado
Adenoma Hepático y sus Características
En el hígado pueden producirse una gran variedad de tumores, algunos de ellos benignos. Uno de estos últimos es el adenoma hepático.
¿Qué es el adenoma hepático?
El adenoma hepático o adenoma hepatocelular (AHC) es un tumor hepático benigno y poco frecuente. Se manifiesta como un nódulo hepático que suele identificarse inicialmente en una ecografía abdominal, como hallazgo incidental.
Se trata de proliferaciones benignas de las células del hígado, los hepatocitos. Los datos de incidencia y prevalencia del adenoma hepático no están bien establecidos, si bien existe una prevalencia descrita de entre el 0,001 y el 0,004% y se diagnostica más comúnmente en mujeres de 35-40años (la proporción de mujeres respecto a los varones es de 10:1).
Causas y factores de riesgo
Varios estudios han respaldado el posible papel de las hormonas sexuales en la aparición del adenoma hepatocelular. Se ha supuesto que, en las mujeres que toman anticonceptivos orales a largo plazo se produce un aumento de 30-40 veces en la incidencia de AHC. Se estima que el riesgo de desarrollo de este tipo de tumor aumenta 25 veces tras 10 años de tratamiento.
Cerca del 4% de los casos tiene lugar en varones. La incidencia del AHC ha aumentado por el aumento del uso de sustancias anabolizantes en relación con el deporte o tras el empleo de esteroides androgénicos anabolizantes en los culturistas.
El reciente aumento de la prevalencia del AHC también se asocia de manera apreciable con la elevación de la prevalencia de la obesidad y del síndrome metabólico.
Existen asociaciones menos frecuentes como la enfermedad de almacenamiento de glucógeno de tipo I, III y IV, con un riesgo aumentado de adenomas inflamatorios (AHC-I), también el Adenoma hepatocelular familiar asociado a la diabetes de inicio en la madurez de tipo 3 (MODY3), la sobrecarga de hierro relacionada con la beta-talasemia y la hemocromatosis.
El alcoholismo y el tabaquismo también se han asociado a la aparición de adenoma hepático en varones.
Características y evolución de los adenomas hepáticos.
Los adenomas hepáticos suelen ser lesiones solitarias, a veces pedunculadas o exofíticas, y de tamaño diverso. El tamaño oscila entre unos milímetros y 30 cm.
Histológicamente, el adenoma hepático consiste en una proliferación de células hepáticas benignas dispuestas con un patrón trabecular con vasos sanguíneos finos por todo el tumor. Contienen varios subgrupos moleculares que están asociados a características morfológicas específicas y riesgos significativos de complicaciones, como lo son:
La rotura del adenoma.
La producción de hemorragias.
La posterior malignización del adenoma.
En casi todos los casos de ruptura espontánea o de hemorragia, la lesión tiene más de 5 cm, aunque los adenomas exofíticos (incluso los de menor tamaño) se asocian a un riesgo superior.
La transformación maligna es relativamente infrecuente (menos del 1%), pero es más común en los adenomas hepáticos con mutaciones activadoras de la ß-catenina, mientras que los adenomas con mutación de HNF-1a rara vez sufren una transformación maligna.
Desde un punto de vista práctico, el curso clínico de los adenomas hepáticos diagnosticados en las mujeres es con frecuencia más benigno, mientras que los diagnosticados en los varones tienen una incidencia significativamente superior de transformación maligna.
Clasificación molecular de los adenomas hepatocelulares
Mediante el análisis genómico, hasta el momento se han identificado claramente tres subtipos moleculares principales de AHC, y hay una cuarta clase no caracterizada en la actualidad.
Adenomas hepáticos inactivados para HNF-1 a (AHC-H), que constituyen un 30-40% de los casos. Los AHC-H se definen por la inactivación del HNF-1a, un factor de transcripción que interviene en el control de la diferenciación y el metabolismo de los hepatocitos.
Adenomas inflamatorios (AHC-I), que suponen un 40-55% de los casos. Los AHC-I constituyen un subgrupo heterogéneo por lo que respecta a la diversidad de mutaciones génicas, aunque todas las mutaciones descritas dan lugar a la activación de la vía de JAK/STAT.
AHC con activación de ß -catenina (AHC- b ), que constituyen un 10-20% de los casos. Los AHC-b se definen por la activación de la ß-catenina en el interior de los tumores.
AHC no clasificados, que suponen un 5-10% de los AHC.
Un pequeño subgrupo no muestra características morfológicas específicas ni tiene ninguna de las mutaciones génicas descritas.
Aunque a partir de 5cm aumenta el riesgo de complicaciones (tanto de sangrado como de aparición de un carcinoma hepatocelular), la determinación del subtipo molecular del adenoma muestra una intensa asociación con el riesgo de transformación maligna a cáncer hepático. De entre los diferentes subgrupos, los AHC-b son los que muestran el mayor riesgo de transformación maligna, incluidos los que tienen un fenotipo doble de ß-catenina e inflamatorio.
Clásicamente se eliminaban quirúrgicamente casi todos los que habían sido diagnosticados. Sin embargo, los adenomas inferiores de 5cm y que no expresan ciertos marcadores (ß-catenina) solo se complican excepcionalmente, por lo que en la actualidad se mantiene un tratamiento conservador en algunos casos.
Síntomas del adenoma hepático
Uno de los principales síntomas del adenoma hepático es el dolor en la parte superior derecha del abdomen donde está situado el hígado. El dolor aparece en tumores muy grandes o cuando hay complicaciones como roturas y hemorragias, por lo que el diagnóstico se produce casualmente con la realización de una ecografía u otra prueba de imagen debido a otra causa.
Diagnóstico del adenoma hepático
El diagnóstico radiológico del adenoma hepático no es sencillo. En cualquier caso, los métodos diagnósticos más empleados incluyen:
La ecografía abdominal. Es útil tanto para diagnóstico como seguimiento.
La eco-doppler y la ecografía con contraste.
El TAC multifase.
La RM con contrastes hepatoespecíficos. Es superior a todas las demás modalidades de diagnóstico por imagen y brinda la oportunidad de determinar el subtipo de AHC hasta en el 90% de los casos.
Tratamiento y Seguimiento
La estrategia terapéutica ha cambiado en los últimos años. Clásicamente, casi todos los adenomas eran extirpados o resecados por las posibles complicaciones. Sin embargo, actualmente se acepta una estrategia más conservadora.
Ante un presunto adenoma hepatocelular, se recomienda repetir la evaluación con RM con contraste al cabo de 6 meses.
Los tratamientos habituales incluyen:
En un adenoma hepático con un tamaño persistentemente superior a 5 cm, o con un aumento del tamaño superior al 20% del diámetro, el tratamiento de primera línea recomendado es extirpar la totalidad del tumor y eliminar todo riesgo de transformación maligna. Las modalidades de tratamiento no quirúrgicas, como la embolización de las lesiones de mayor tamaño o la ablación de las más pequeñas, pueden utilizarse como alternativa a la resección.
Se recomienda una resección o un tratamiento curativo para todos los adenomas hepáticos diagnosticados en los varones, dada la incidencia significativamente superior de transformación maligna que se da en ellos.
Se recomienda una intervención curativa en el caso de los adenomas hepáticos con mutación de ß -catenina activada, sea cual sea su tamaño cuando se ha determinado la histología por biopsia.
En las mujeres, los adenomas hepáticos de menos de 5cm en el examen inicial rara vez sufren una ruptura y la transformación maligna es menos frecuente. Se recomienda un cambio de estilo de vida, dejar de tomar anticonceptivos orales y un control del peso corporal. Las lesiones de menos de 5 cm deben ser evaluadas de nuevo al cabo de 1 año, y luego deben realizarse nuevas exploraciones de imagen a intervalos anuales.
Un adenoma hepatocelular con un sangrado que comporte inestabilidad hemodinámica debe ser objeto de embolización. Además, la presencia de una lesión viable residual en un examen de imagen de seguimiento constituye una indicación para la resección.
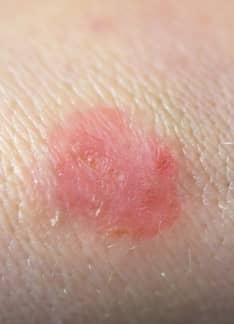
Artículo especializado
Escara o úlcera por presión: ¿Qué es?
La escara o úlcera por presión es una lesión de la piel causada por la presión en las partes de apoyo que ejerce el propio cuerpo.
¿Qué es una escara?
Una escara o úlcera por presión es una lesión de la piel y los tejidos subyacentes con pérdida de sustancia cutánea producida por una presión prolongada o fricción.
Se trata de un problema grave y frecuente en personas de edad avanzada. Representa una de las principales complicaciones de las situaciones de inmovilidad, en las que tienen lugar el aplastamiento de los tejidos por una prominencia ósea que ejerce presión durante un período prolongado sobre la superficie externa.
Las presiones elevadas ejercidas sobre un área concreta durante un tiempo prolongado desencadenan un proceso isquémico que puede originar la muerte celular y la necrosis si no se interviene a tiempo.
En la formación de la úlcera parece tener más relevancia la continuidad en la presión que su intensidad. Esto es debido a que la piel está diseñada para soportar presiones elevadas, pero sólo durante cortos períodos de tiempo.
Cuál es la causa de una úlcera por presión
Los principales factores que contribuyen al desarrollo de las escaras de la piel son:
La presión . Es la fuerza que se ejerce en dirección perpendicular a la piel por la gravedad sobre el propio cuerpo. Esta provoca el aplastamiento de los tejidos que impide el flujo sanguíneo. La consiguiente hipoxia en los tejidos dará lugar a la necrosis. Es el factor de riesgo más importante.
La fricción . En este caso, la fuerza actúa paralelamente a la piel, produciendo roces por movimiento o arrastre. La humedad es un factor que aumenta la fricción, además de macerar la piel.
El pinzamiento vascular . Combina los efectos de presión y fricción que se pueden dar en algunas posturas.
Grados de úlceras por presión
Cuando aparece una úlcera por presión es necesario realizar una valoración integral e identificar su localización y el alcance de las lesiones. Los trocánteres de las caderas, el sacro, glúteos y talones son las zonas donde aparecen con mayor frecuencia.
De igual modo, es necesario valorar el grado de las úlceras por presión identificadas:
Grado 1 . Se produce eritema cutáneo que no palidece.
Grado 2 . La úlcera es superficial y presenta aspecto de abrasión, ampolla o cráter superficial. Incluye pérdida de piel de espesor parcial que involucra la epidermis, dermis o ambas.
Grado 3 . Se produce pérdida total del grosor de la piel que implica lesión o necrosis del tejido subcutáneo, que puede extenderse hacia abajo.
Grado 4. Se produce pérdida total del grosor de la piel con destrucción extensa, necrosis del tejido o lesión en músculo, hueso o estructura de sostén. En este estadio pueden presentarse lesiones con caverna, tunelizaciones o trayectos sinuosos.
Síntomas de las escaras
Los síntomas y signos que acompañan a las úlceras por presión incluyen:
Cambios en el color o en la textura de la piel.
Inflamación.
Supuración.
Aumento de la temperatura al tacto de una zona de la piel.
Como se ha visto en los diferentes grados, las úlceras de presión pasan por distintas fases de evolución y gravedad que se diferencian por su profundidad, severidad y afectación de tejidos. El grado de daño de la piel y los tejidos oscila desde cambios en el color hasta una lesión profunda que puede afectar a músculos y estructuras óseas.
Escaras en personas mayores
Cualquier persona que debe permanecer largo tiempo en cama o inmovilizada puede padecer úlceras por presión. Sin embargo, suele ser un problema muy habitual en las personas mayores, debido a que presentan una mayor proporción de movilidad reducida y de situaciones de salud que requieren largos períodos de reposo.
De este modo, las escaras o úlceras por presión se producen por el contacto continuo de la piel con una superficie. Esta clase de contacto debe de ser continuo y durante un periodo largo de tiempo. Por lo tanto, el paciente tipo que pasa en cama un periodo largo de tiempo y que presenta una movilidad reducida suele ser una persona de edad avanzada.
Cuidados de la piel en pacientes con escaras
La curación de las úlceras y los cuidados que requieren dependerán de la causa, las características y la localización de las mismas. Sin embargo, se pueden establecer algunas recomendaciones sobre los cuidados que requieren las úlceras por presión:
Independientemente de la causa, una úlcera debe mantenerse limpia y sin infección. Existen múltiples apósitos curativos con sustancias hidrocoloides, alginatos o ácido hialurónico capaces de acelerar la curación. El manejo de una úlcera debe tener en cuenta la fase en la que se encuentra y sus características. En ocasiones, la compresión adecuada con medias o vendas puede ser positiva para acelerar la curación, así como mantener las extremidades elevadas para mejorar el retorno venoso.
Si se sospecha que hay una infección de la úlcera se debe recurrir a antibióticos. Estos pueden ser tópicos (en cremas) u orales, pero siempre prescritos por un médico.
Se debe revisar la piel del enfermo inmovilizado o encamado, por lo menos una vez al día. Prestar especial atención a las zonas típicas de presión: talones, glúteos, espalda, codos y parte posterior de la cabeza.
No utilizar sobre la piel alcohol o sustancias irritantes.
Evitar la sequedad de la piel con el uso de cremas o aceites hidratantes que deben ser absorbidos completamente.
Evitar el aire frío o seco.
Utilizar ropa de cama de tejidos naturales y suaves. Mantenerla seca, limpia y sin dobleces ni arrugas.
Colocar en las zonas típicas de presión protectores o apósitos acolchados.
Llevar a cabo cambios de posición frecuentes durante el día y la noche.
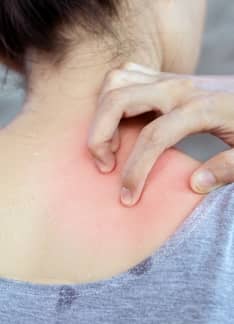
Artículo especializado
Alergia al sudor y cómo identificarla
En ocasiones se pueden producir reacciones alérgicas relacionadas con la interacción con el ambiente, incluyendo los cambios de temperatura, el calentamiento corporal e, incluso, ante la aparición del propio sudor.
¿Qué es la alergia al sudor?
La alergia al sudor es una reacción anormal mediada por el sistema inmune ante el aumento de temperatura producido en el organismo que suele ir acompañado de la aparición de sudor. De este modo, se producen alteraciones en la piel, incluyendo dermatitis, enrojecimiento y ronchas en las zonas de la piel que presentan un mayor nivel de sudoración (axilas, brazos, piernas y abdomen).
Se trata de una afección que se agrava cuando se practica deporte de manera intensa o durante el verano.
La alergia al sudor está íntimamente ligada a la alergia al calor o urticaria colinérgica . En ella se presentan pequeñas pápulas de 2-3 mm con halo eritematoso normalmente en el tronco, brazos y piernas. Es causada por el aumento de temperatura corporal, ya sea de forma activa (ejercicio, estrés, etc.) o pasiva (exposición a agua caliente).
El mecanismo por el cual se produce la alergia al sudor no es bien conocido. Parece obedecer a trastornos a nivel celular que determinan la liberación de histamina ante la presencia de acetilcolina procedente de las fibras nerviosas colinérgicas por causa de la detección del aumento de temperatura. También puede tratarse directamente de una reacción alérgica ante un alérgeno presente en el propio sudor que desencadena la reacción del sistema inmunitario.
Síntomas de la alergia al sudor
Los síntomas desencadenados por la alergia al sudor pueden aparecer a cualquier edad. Sin embargo, suelen ser más frecuentes en bebés y niños. También pueden aparecer en personas de edad avanzada y personas postradas en cama.
Entre los síntomas más habituales se encuentran:
Pequeñas ronchas rojas o sarpullido en las zonas de la piel que más transpiran o están más expuestas al sudor.
Prurito o picor en las zonas afectadas.
Costras y lesiones cutáneas debido al rascado que se produce por el picor.
Por otro lado, cuando la persona permanece mucho tiempo expuesta a altas temperaturas o a situaciones de mucha sudoración, pueden aparecer síntomas como:
Náuseas y vómitos.
Diarrea.
Dificultad para respirar.
Fatiga.
Cómo tratar la alergia al calor
El tratamiento de la alergia al sudor y al calor consiste en cuidar el estado de hidratación corporal, además de hidratar bien la piel con cremas que presenten una acción calmante.
También pueden ser beneficiosos los baños con agua fría y la utilización de ropa ligera, así como permanecer en ambientes frescos y aireados.
De igual modo, como ocurre con otro tipo de alergias, pueden utilizarse medicamentos antihistamínicos para reducir los síntomas de la alergia al sudor y al aumento de temperatura. Se puede optar por antihistamínicos orales o cremas de uso tópico con componentes antihistamínicos. Debe ser siempre el Dermatólogo el que determine el tratamiento más conveniente en cada caso.
Cómo tratar síntomas severos de la alergia al sudor
Si las medidas y tratamientos señalados anteriormente no son suficientes para resolver el problema, se podría optar por la prescripción de cremas que incluyeran corticoides, siempre con la indicación expresa del Dermatólogo. Este tipo de medicamentos deben ser siempre utilizados con sumo cuidado, en pequeñas cantidades, extendiéndolas bien y durante breve período de tiempo para no causar perjuicios en la piel. El especialista en Dermatología decidirá la potencia del corticoide según la zona afectada, la edad del paciente y el tiempo de uso para evitar efectos adversos. A veces puede ser conveniente añadir un antibiótico para tratar las sobreinfecciones debidas al rascado del paciente por el picor.
Finalmente, evitar los síntomas y reacciones que se producen debido a la alergia al sudor y al calor puede requerir la renuncia a realizar actividades deportivas o situaciones que provoquen una sudoración excesiva, como ambientes calurosos o situaciones estresantes. En ocasiones puede ser difícil conseguirlo, especialmente durante el verano. En casos extremos o si no se quiere renunciar, por ejemplo, a la realización de actividades deportivas, se puede optar por un tratamiento específico para reducir la sudoración, como la aplicación de lociones antitranspirantes o el tratamiento con bótox en zonas específicas de la piel.
En cualquier caso, ante la aparición de una reacción alérgica de cualquier naturaleza, siempre es recomendable consultar con el Dermatólogo.

Artículo especializado
Chinches de cama: síntomas y tratamiento
Las chinches de cama constituyen una de las plagas comunes más difíciles de controlar. Aunque la proliferación de insecticidas del pasado redujo su incidencia notablemente, sus infestaciones se han vuelto cada vez más frecuentes en los últimos años. La gran movilidad de la población y el aumento de las resistencias a los insecticidas, son dos de los principales factores.
¿Qué son las chinches de cama?
Las chinches de cama − Cimex lectularius , pertenecientes a la familia Cimicidae, dentro del orden Hemíptera− son pequeños insectos que parasitan a las personas y se alimentan de su sangre.
Tanto los adultos (machos y hembras), como las ninfas de las chinches de cama se alimentan de sangre. Los humanos son excelentes huéspedes para las chinches, ya que suelen vivir en espacios cerrados, duermen de manera regular en el mismo lugar y tienen una piel fina con una abundante irrigación sanguínea.
La picadura que producen para obtener la sangre suele provocar picor y síntomas leves.
Por otro lado, no existen evidencias que relacionen las chinches de la cama con la transmisión de infecciones o enfermedades humanas.
Cómo identificar a las chinches de la cama
Las chinches adultas presentan una coloración marronácea y una forma oval, con una longitud de 4 a 7 mm. Tienen seis patas y, aunque no tienen alas, pueden moverse a gran velocidad.
Los huevos de las chinches de cama tienen un tamaño aproximado de 1 mm de largo por 0,5 mm de ancho. Su color es blanquecino y opaco.
Sin contar las picaduras que provocan, los rastros que pueden ayudar a identificar la presencia de chinches de cama incluyen las mudas de los estadios ninfales, los huevos (eclosionados o sin eclosionar), las manchas de excrementos marrón oscuro o negras y un olor que recuerda al cilantro.
Las ninfas son la versión en desarrollo de las chinches adultas y presentan una cutícula mucho más delgada y transparente.
Las chinches se pueden encontrar en ambientes rurales y urbanos, tanto en domicilios como en albergues y hoteles.
Síntomas de la picadura de chinches
Las chinches de la cama suelen picar en áreas expuestas de la piel. De este modo, la mayoría de las picaduras se localizan en el abdomen, en el cuello, los brazos y las piernas.
Habitualmente, pican dos o tres veces en la misma zona de la piel para succionar la sangre y continuar avanzando, produciendo por el camino más picaduras. Así, pueden encontrarse lesiones múltiples, a menudo con una distribución lineal o agrupadas. Las lesiones tienen una apariencia variable, a menudo como hinchazones o ronchas rojizas, parecidas a las picaduras de las pulgas.
La molestia y el prurito producido por las picaduras suelen ser elevados y existe la posibilidad de infecciones secundarias por el rascado y reacciones alérgicas en casos esporádicos.
Causas de una infestación de chinches
Las chinches de cama se trasladan y dispersan gracias a los viajeros, en elementos como maletas, mochilas y también en algunos muebles. En lugares donde exista un constante cambio de personas residentes, como hoteles, residencias y albergues, el riesgo de aparición de chinches es más elevado.
Las chinches de cama tienen muy bien definidos sus nidos o refugios, en los que se suele encontrar grupos de individuos en distintos estados de desarrollo, incluyendo huevos, ninfas y adultos.
En estos nidos es donde se produce una parte esencial del ciclo de vida del insecto y donde completan su desarrollo.
Cómo eliminar las chinches de cama
Cuando se localizan chinches en una cama o domicilio, una de las cuestiones más importantes es realizar una inspección exhaustiva y profunda para identificar todas las zonas, habitaciones y camas afectadas. Si se aplican insecticidas y se dejan zonas al margen en las que también haya insectos, el tratamiento no habrá servido de nada, ya que volverán a proliferar en un periodo corto de tiempo.
El lugar más habitual donde se pueden encontrar las chinches es la cama. Una inspección minuciosa conlleva desmontar la cama y analizar todas sus partes. Esto incluye superficies, costuras, recovecos y grietas.
De este modo, se pueden encontrar chinches en diferentes zonas de la habitación, incluyendo:
Estructura, patas y cabecera de la cama.
Incluyendo las costuras, pliegues y debajo de los botones.
Almohadas y cojines.
Ropa de cama.
Mesitas de noche y otros muebles cercanos.
En la pared: hendiduras, grietas y papel pintado.
Dentro de enchufes, interruptores, teléfonos, despertadores, etc.
Bajo la moqueta.
En maletas y bolsas de viaje.
Etc.
Una vez identificadas todas las zonas donde se encuentran las chinches anidadas, se debe proceder a aplicar tres productos de las distintas familias de insecticidas de manera secuencial para hacer frente a las posibles resistencias.
En el caso de tejidos y prendas de vestir, el lavado a 60 °C durante 30 minutos es suficiente para matar a las chinches en cualquiera de sus estadios de crecimiento.
Si fuera necesario o no se consiguiera erradicar la plaga, sería recomendable recurrir a los servicios de exterminación por parte de profesionales cualificados.
Tratamiento de picadura de chinche
Lo recomendable, una vez detectadas las picaduras de las chinches, es lavarlas con agua y jabón y aplicar una crema específica para picaduras que contribuirá a disminuir el picor.
Si el picor es muy intenso, pueden ser de ayuda los antihistamínicos orales, que deberán ser prescritos por el especialista. Esto contribuirá a no rascarse, lo que evitaría la aparición de potenciales infecciones. De este modo, cuando el picor es muy intenso o se produce una reacción alérgica, es recomendable acudir al médico.
 Savia
Savia