Artículos Especializados

Artículo especializado
Dislipemias: Detección y Control
El concepto dislipemia indica una alteración de los niveles de lípidos en sangre , considerando éstos como un conjunto de partículas entre las cuales destacamos el colesterol total, colesterol HDL (comúnmente denominado “bueno”), colesterol LDL (“malo”) y triglicéridos, además de otras partículas como el colesterol VLDL, IDL y las apoliproteinas apoB.
La detección y análisis de estos lípidos es de vital importancia ya que se consideran marcadores de riesgo cardiovascular que nos pueden ayudar a prevenir y detectar enfermedades de riesgo cardiovascular. Es más, eliminando los comportamientos de riesgo para la salud se podrían evitar, al menos, el 80% de las enfermedades cardiovasculares (ECV).
Estas enfermedades son l a primera causa de muerte prevenible en España , siendo responsable de más del 30 % de las defunciones.
Clasificación de las dislipemias
Según su origen, las dislipemias pueden ser:
Hereditarias, es decir, derivadas de alteraciones en los genes que interfieren con la capacidad del organismo para absorber y eliminar las grasas, por lo que sus causas no son modificables. En este tipo de dislipemias primarias cabe destacar la hipercolesterolemia familiar, enfermedad monogénica más frecuente.
Relacionadas con el estilo de vida (causas modificables y, por tanto, evitables). En este último grupo de dislipemias, a su vez podemos clasificarlas en otras causas:
Alimentarias: excesivo consumo de grasas saturadas, carbohidratos y azúcares y bajo consumo de frutas, verduras y fibra.
Hábitos tóxicos : consumo de tabaco, alcohol y otras drogas
Sedentarismo
Fármacos que afectan de forma adversa al perfil lipídico: diuréticos, bloqueadores β-adrenérgicos, progestágenos, contraceptivos orales con progestágenos de segunda generación, danazol, inmunosupresores, inhibidores de la proteasa y antiepilépticos
Presencia de enfermedades asociadas a dislipemia : hipotiroidismo, obesidad, diabetes mellitus tipo 2 y enfermedad renal crónica (ERC).
Según las alteraciones en la concentración de los distintos lípidos en sangre, las dislipemias se pueden clasificar en :
Hipercolesterolemia: dislipemia con incremento de los niveles de colesterol
Hipertrigliceridemia: dislipidemia con incremento de las concentraciones de triglicéridos
Dislipemia mixta : cuando el incremento de lípidos corresponde tanto a colesterol como a triglicéridos.
Dislipemia aterogénica
Además de esta clasificación, hay que tener en cuenta que existen dislipemias unidas a otros factores de riesgo cardiovascular como es el caso de la denominada dislipemia aterogénica, patología que se caracteriza por un aumento de los triglicéridos (TG) un descenso del colesterol unido a lipoproteínas de alta densidad (cHDL) y una alta proporción de partículas LDL pequeñas y densas con o sin incremento moderado de colesterol cLDL.
Esta dislipemia está presente en personas que padecen diabetes tipo 2, síndrome metabólico u obesidad visceral, y que, aún con tratamiento farmacológico (estatinas), siguen presentando valores elevados de TG y bajos de cHDL Esto último indica que se trata de un riesgo que no está asociado obligatoriamente a un aumento de cLDL.
Síntomas y evaluación de riesgos cardiovasculares
La importancia de evaluar analíticamente los parámetros lipídicos con el fin de predecir el riesgo cardiovascular es que la dislipemia, en sí, es una enfermedad asintomática a excepción de las manifestaciones clínicas de las dislipemias genéticas, como el xantoma tendinoso ( irregularidades de los tendones) , el xantelasma (pequeñas manchas o bultos en la zona de los párpados) , y el arco corneal prematuro ( anillo blanco en la periferia del iris ).
Por ello, si no se hace un control de los factores de riesgo cardiovascular (FRCV), pueden aparecer complicaciones asociadas a esta enfermedad entre las que destacan: pancreatitis aguda, síndromes coronarios e ICTUS , que son los causantes de la mayoría de los fallecimientos.
Además, existen diferentes condiciones clínicas que se asocian con un aumento del riesgo de ECV y de dislipemia entre las que destacamos:
Las enfermedades inflamatorias crónicas autoinmunitarias: artritis reumatoide, lupus eritematoso sistémico y psoriasis
Las personas que padecen enfermedad renal crónica (ERC)
La diabetes o hipertensión en mujeres durante el embarazo
La disfunción eréctil en varones
Parámetros analíticos a tener en cuenta
Las analíticas de sangre convencionales pueden evaluar parámetros como : CT (colesterol total), cHDL, c-LDL y TG (triglicéridos). En particular, sabemos que el valor de c-LDL se calcula de forma indirecta mediante la siguiente fórmula:
Además, hay que tener en cuenta que el estudio e interpretación de estos parámetros de forma aislada no proporciona información acerca del riesgo cardiovascular, ya que un valor muy elevado de colesterol total, por sí solo, no es predictivo de futuras complicaciones . De hecho, existen diferentes cocientes que nos pueden orientar acerca del riesgo cardiovascular y sus resultados óptimos deberían ser:
TG / cHDL menor de 3.
LDL / HDL menor de 3.
CT / cHDL menor de 5.
Objetivos para el manejo de las hipercolesterolemias
El principal parámetro que hay que controlar en el manejo de este tipo de dislipemia es el cLDL, cuyos objetivos son :
cLDL < 2,6 mmol/l (100 mg/dl) en personas con un riesgo CV total alto.
cLDL < 1,8 mmol/l (70 mg/dl) en personas con un riesgo CV total muy alto.
cLDL es < 3 mmol/l (115 mg/dl) en personas con un riesgo CV moderado.
Objetivos para el manejo de las hipertrigliceridemias
Las lipoproteínas ricas en TG son un factor de riesgo CV y se recomienda mantener valores en ayunas ≤ 1,7 mmol/l (150 mg/dl). Además, según su concentración plasmática también podemos clasificar la HTG en:
Leve a moderada cuando TG> 1,7 mmol/l (150 mg/dl) y < 10 mmol/l (880 mg/dl).
Grave cuando TG > 10 mmol/l. este tipo de HTG se asocia a un riesgo aumentado de pancreatitis.
Por otra parte, a día de hoy, no se han establecido objetivos específicos de cHDL y TG en personas con riesgo cardiovascular, aunque sí podemos decir que el cHDL elevado tiene un efecto protector ante la ateroesclerosis mientras que el cHDL bajo se asocia a un aumento de mortalidad en pacientes con enfermedad cardiovascular aun teniendo el cLDL es < 1,8 mmol/l (70 mg/dl).
Tratamiento y prevención
El objetivo principal ante el diagnóstico de cualquier dislipemia es evitar la ateroesclerosis como causa intermedia en la enfermedad cardiovascular. En consecuencia, toda persona que presente elevados factores de riesgo cardiovascular o quiera prevenirlos, debe conocer cómo afectan esos factores a su salud, por lo que el tratamiento primario se basa en modificar su estilo de vida:
Alimentación saludable : existen evidencias sólidas que demuestran que los factores dietéticos pueden modular la termogénesis directamente o a través de un efecto en los lípidos plasmáticos, la presión arterial y la concentración de glucosa.
Práctica de actividad física .
Normalización del peso .
Supresión de hábito tabáquico y alcohólico .
Por otra parte, la prescripción de tratamiento farmacológico debe ser individualizada y evaluada por un médico, teniendo en cuenta la presencia de otros factores de riesgo cardiovascular y enfermedades asociadas que pueda padecer el paciente. Sin embargo, los fármacos de primera elección en la prevención secundaria suelen ser las estatinas, ya que reducen el riesgo de ECV total mediante la reducción del cLDL y evitan la elevación moderada de los TG. Sin embargo, hay que tener en cuenta que este fármaco sólo se debe emplear en aquellos casos en que los beneficios que se esperen superen a sus efectos secundarios .
Artículo especializado
¿Cómo Interpretar unos Análisis de Orina?
Si has recibido el resultado de unos análisis de orina y tienes interés en su interpretación rápida, aquí te damos una serie de pautas para conseguirlo tú mismo/a.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
¿Para qué se utiliza?
El examen de orina es usado como método diagnóstico complementario en medicina. Es indoloro y de simple recolección (40-50 ml de orina en un recipiente de plástico), siendo por ello menos molesto para los pacientes que un análisis de sangre.
El análisis de orina puede ofrecernos pistas importantes sobre enfermedades del organismo , principalmente sobre las enfermedades de los riñones.
Las tres opciones de estudio son las siguientes:
Tira reactiva de orina y sedimento urinario.
Cultivo de orina (urocultivo) y antibiograma.
Estudio de orina de 24h.
Tira reactiva y sedimento urinario
La orina puede ser recogida en cualquier momento del día y cuanto más fresca sea, más fiables son los resultados. Si no puede ser entregada inmediatamente, debe ser conservada bajo refrigeración.
Para la primera prueba (tira reactiva), simplemente se sumerge la tira reactiva llamada Labstix ® en el recipiente de orina. Cada tira posee unos cuadraditos de colores compuestos por sustancias químicas que reaccionan con determinados elementos de la orina. Después de un minuto, se comparan los colores de los cuadraditos con una tabla de referencia que suele venir en el envase de las tiras. Los resultados son principalmente cualitativos (identifican la presencia de la sustancia), y la cuantificación es apenas aproximada mediante una gradación de cruces (1+ informa de poca cantidad y 4+ de una gran cantidad. Menos de 1+ serían los ”trazos”).
Podemos detectar y estudiar los siguientes parámetros:
Densidad: la densidad del agua pura es igual a 1000. Los valores de densidad en la orina normales varían de 1005 (orina más diluida) a 1035 (más concentrada, pudiendo indicar deshidratación). Cuanto más concentrada es la orina, más amarilla aparece y emite hedor más intenso.
pH : la orina es ácida (pH 5.5 a 7,0), ya que el riñón es el principal medio de eliminación de ácidos del organismo. Los pH superiores a 7 pueden sugerir la presencia de bacterias, que alcalinizan la orina, mientras que pH inferiores a 5.5 pueden indicar un estado acidótico en la sangre o enfermedad de los túbulos renales.
Glucosa: toda la glucosa (azúcar) que es filtrada por los riñones es reabsorbida hacia la sangre por los túbulos renales. Por ello lo normal es no observar presencia de glucosa en la orina. Si la hubiera es un fuerte indicio de que los niveles sanguíneos de glucosa son altos, y el riñón no es capaz de reabsorberla toda, como pasa en la diabetes mellitus.
Proteínas : la mayoría de las proteínas no pasa el filtro del riñón, por eso, en situaciones normales no deben estar presentes en la orina (existe apenas una pequeña cantidad). Su presencia puede indicar enfermedad renal y debe ser siempre investigada.
Hematíes (sangre): su cantidad en la orina es insignificante por lo que, de forma general, se considera una orina normal cuando no hay presencia de hematíes.
Leucocitos (esterasa leucocitaria): normalmente negativos (mínima presencia).
Cetonas: son productos de metabolización de las grasas y normalmente no están presentes en orina. Su presencia en la orina sugiere ayuno prolongado o, junto a otros parámetros alterados, una diabetes mellitus mal controlada.
Urobilinógeno y bilirrubina: también normalmente ausentes en orina, su presencia puede sugerir enfermedad de hígado o hemólisis (destrucción anormal de hematíes o glóbulos rojos en la sangre).
Nitritos: la orina es rica en nitratos, y la presencia de bacterias en la orina los transforma en nitritos. No obstante, no todas las bacterias tienen esa capacidad por lo que un resultado negativo no excluye el diagnóstico de infección de orina.
Cristales: los de oxalato de calcio no poseen ninguna significación clínica. No indican una mayor propensión a padecer cálculos renales.
La segunda prueba (sedimento de orina) consiste en observar la orina al microscopio en el laboratorio y con ella se pueden contabilizar los siguientes elementos:
Hematíes (o glóbulos rojos -sangre-): los valores normales se describen como: menor de tres a cinco hematíes por campo. La presencia de niveles más elevados se llama hematuria.
Leucocitos (o glóbulos blancos): son nuestras células de defensa y su presencia en la orina sugiere, generalmente, infección de orina, pero pueden significar cualquier inflamación de las vías urinarias (incluida la no causada por un agente infeccioso). Los valores normales son: menores a cinco células por campo. La presencia de valores más elevados se llama leucocituria o piuria.
Células epiteliales: su posible presencia es normal, dado que las propias células del tracto urinario se descaman.
Cilindros: como los túbulos renales son cilíndricos, si tenemos alguna sustancia en gran cantidad en la orina (proteínas, células epiteliales, hematíes) ésta se agrupa en forma de cilindro al pasar a través de ellos. La presencia de cilindros indica que esa sustancia ha pasado por los túbulos renales y, por tanto, no proviene de afecciones de estructuras posteriores a los túbulos, como es el caso del uréter, vejiga, próstata, etc. Los cilindros que pueden indicar algún problema son los cilindros hemáticos, que pueden mostrar la existencia de una enfermedad renal denominada glomerulonefritis, así como los cilindros leucocitarios, que pueden indicar inflamación (general) de los riñones.
Bacterias.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Urocultivo y antibiograma
La presencia de hematíes, asociado a leucocitos y nitritos positivos habla mucho a favor de una infección de orina , no obstante, el examen más específico es el urocultivo . Consiste en incubar la orina en medios de crecimiento bacteriano específicos y observar si las bacterias se multiplican, formando colonias visibles a simple vista. Se considera positivo un recuento igual o superior a 10E6 UFC (unidades formadoras de colonias)/ml (mililitro) de orina.
Con el antibiograma se mide la sensibilidad-resistencia de las bacterias que salen positivas en la orina a los antibióticos habitualmente utilizados para su tratamiento y así optimizarlo.
Examen de orina de 24 horas
Esta prueba se realiza, principalmente, para cuantificar con exactitud las proteínas que se están perdiendo por la orina en determinadas enfermedades. Pero también sirve para cuantificar otros parámetros como el volumen total de orina emitido en 24 horas o la cantidad de electrolitos (sodio, potasio, cloro…) o de otros metabolitos (urea, creatinina…) que también se eliminan por la misma, entre otros aspectos.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.

Artículo especializado
¿Te Apuntas a la Marcha Nórdica?
Ya no resulta extraño ver a personas caminando con bastones por la montaña, la playa o por la calle, pero lo que no todo el mundo sabe es que según la técnica que se ponga en práctica o el tipo de bastones que se utilicen, se estará ante una modalidad de marcha diferente. Te explicamos más acerca de la marcha nórdica. Seguro que al acabar de leer el artículo te apetece probarla…
Su origen
En 1930 se habla por primera vez de una nueva modalidad de marcha. La ponen en práctica un grupo de esquiadores de esquí nórdico finlandeses que, para no perder la forma física durante la época de calor, cuando no podían seguir practicando su deporte, emulaban la técnica del esquí caminando y corriendo con bastones . Era la manera perfecta para poder seguir entrenando sin perder la base de su deporte. El esquí nórdico se caracteriza por tener una técnica muy depurada en la que el esquiador debe tener el control en todo momento de su posición corporal, así como del movimiento, no sólo de piernas sino también de los brazos, entre los que debe existir un gran sincronismo y coordinación. El trabajo simultáneo de brazos, piernas y tronco es necesario para conseguir un desplazamiento correcto. Estas mismas características las ha “abrazado” la marcha nórdica que con el complemento de los bastones permite realizar un trabajo combinado tanto a nivel cardiovascular como muscular.
Su evolución
Unos años más tarde, se empieza a pulir la técnica siempre teniendo muy en cuenta la biomecánica propia de la marcha humana y es en 1988, cuando también desde Finlandia, se desarrolla una técnica de marcha con bastones propios, característicos y específicos para la marcha nórdica. Poco a poco, esta disciplina va ganando terreno y en 1997 se le da ya el nombre oficial de Nordic Walking y se va conociendo y practicando en más países hasta que, a partir del año 2000, se crean ya asociaciones concretas a nivel mundial para regular y supervisar su práctica.
Muchos beneficios
La marcha nórdica nace, como hemos mencionado, como una alternativa “veraniega ” para que los esquiadores siguiesen entrenando, pero hoy en día es una actividad física más, que ofrece múltiples beneficios para la salud. Es una excelente actividad que pueden practicar personas de cualquier edad y sin necesidad de tener una gran forma física, pues la marcha nórdica es una herramienta para conseguirla.
Mejora la salud cardiovascular: al andar nuestro corazón y vasos están activos, lo que permite actuar a nivel de parámetros como la tensión arterial, por ejemplo. Además, se pueden controlar valores como la glucosa en sangre o el colesterol por lo que es adecuado para aquellos que quieren prevenir patologías asociadas al metabolismo de estos productos o para quien sufre ya alguna alteración y quiere controlarlo y reducirlo.
Menor impacto articular: al ser una actividad en la que existe impacto articular, pero menor que en otras modalidades como correr o aquellas que incluyen saltos, es perfecta para a quien tiene problemas a nivel articular, pero quiere seguir moviéndose.
Mayor estabilidad: hay que tener en cuenta que al llevar bastones existe una mayor estabilidad que si no se llevan.
Ayuda para perder peso: es también una actividad aeróbica para incluir en un programa con el objetivo de perder peso, dependiendo de la capacidad y las condiciones individuales se puede someter al organismo a una menor o mayor exigencia y con ello aumentar el consumo calórico.
Se trabaja nivel muscular: son muchas las localizaciones que se activan con el balanceo de los brazos y la propia marcha, como los músculos de la espalda, hombros, los brazos y los abdominales, además de los glúteos, que se trabajan y se tonifican.
Más flexibilidad, fuerza y coordinación: de manera indirecta existen una serie de cualidades que van a mejorarse con la práctica de la marcha nórdica entre ellas la flexibilidad, fuerza o coordinación por lo que refuerza aún más los efectos positivos globales para el organismo.
ACTIVIDAD RECOMENDADA EN CÁNCER DE MAMA
Últimamente esta disciplina ha tenido una mayor repercusión en ámbito sanitario, por recomendarse a pacientes con cáncer, en concreto con cáncer de mama . Mujeres que se han sometido a cirugía por un cáncer de mama son tributarias de esta actividad ya que la técnica quirúrgica afecta de manera específica a la zona axilar que puede limitar la movilidad del brazo y de la zona intervenida. Al marchar se movilizan músculos de las extremidades superiores, lo que permite aumentar el rango de movimiento y la propia movilidad y en paralelo se reduce el dolor de manera progresiva, lo cual mejora la calidad de vida de la paciente.
La importancia de la técnica y del material
Para que todos los efectos beneficiosos se obtengan es importante conocer la técnica y también hacer uso del material adecuado ya que no todos los bastones valen.
Material: unos correctos bastones son imprescindibles para realizar la marcha nórdica de la manera más adecuada. Estos, a diferencia de los que se usan para hacer senderismo tienen unas características concretas como el apoyo, estos tienen un final que tiene una forma concreta para mejorar el movimiento al apoyar el bastón en el suelo. La sujeción es otro de los puntos importantes, en la empuñadura existe lo que se conoce como dragonera , que es una especie de muñequera da mayor seguridad en el agarre todo ello pensado para una mejor funcionalidad que es la de ayudar a la propulsión del cuerpo durante la marcha. En cuanto al material de fabricación a mayor sea el porcentaje de carbono , menos vibraciones en las articulaciones y en los brazos y mayor ligereza.
Técnica: la misma importancia que tiene un buen material lo tiene una buena técnica y es por ello que se recomienda antes de empezar pedir consejo a profesionales. Respetar la biomecánica de la marcha es una de las características de esta modalidad. Los brazos se colocan hacia atrás con las manos sujetando los bastones y se realiza el movimiento de la marcha ayudándose de los bastones para impulsarse. El movimiento de los brazos sale de los hombros y no de los codos. No es complicado simplemente hay que tener un mínimo conocimiento.
Artículo especializado
Fosfatasa Alcalina: ¿Hígado o Hueso?
Como has supuesto bien, si hablamos de fosfatasa alcalina es porque también existe la fosfatasa ácida. Tan sólo una pincelada para diferenciar ambas.
La fosfatasa ácida es una enzima repartida por todo el organismo que tiene cinco isoenzimas. Las isoenzimas son moléculas o proteínas muy parecidas entre ellas (tan sólo difieren en alguna pequeña secuencia) que participan en el mismo proceso metabólico. La isoenzima de la fosfatasa ácida más relevante en nuestra práctica clínica es la específica de la próstata o isoenzima 2. Sus valores están muy elevados en pacientes con cáncer de próstata. Por tanto, se solicita tanto para el diagnóstico como para el estudio de extensión del tumor. Nos ayudará en la monitorización de la respuesta al tratamiento.
La fosfatasa alcalina es un grupo de enzimas presentes en numerosos tejidos (hígado, hueso, riñón, intestino, placenta) y en células sanguíneas. Sus concentraciones más elevadas se observan en células óseas y hepáticas, por ello, concentraciones elevadas de fosfatasa alcalina en sangre suelen asociarse a trastornos hepáticos u óseos. Igual que en el caso de la fosfatasa ácida, posee diferentes isoenzimas en el organismo que identifican el origen.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
En adelante abordaremos la fosfatasa alcalina
Algunos tipos de cáncer producen isoenzimas de la fosfatasa alcalina que se detectan en sangre. Es el caso de pulmón, testículo (seminoma), próstata, laringe, páncreas, estómago, y colon.
En condiciones normales los niveles sanguíneos de fosfatasa alcalina proceden, a partes iguales, del hígado y el hueso . Puede haber oscilaciones durante el embarazo y en las edades extremas de la vida así como durante el crecimiento (en niños y adolescentes es característico hallar concentraciones de fosfatasa alcalina aumentadas, debido a su crecimiento óseo).
Por tanto, los resultados de la determinación de la fosfatasa alcalina deben interpretarse de manera diferente en niños y adultos.
¿En qué situaciones podemos encontrar unas fosfatasas alcalinas elevadas?
En primer lugar, sospecharemos una alteración hepática u ósea , aunque pueden existir otras causas. Podemos diferenciar los distintos tipos de isoenzimas de fosfatasa alcalina producidos por el organismo para identificar su procedencia. Los síntomas y signos acompañantes pueden orientarnos sobre el origen óseo o hepático de un aumento de la fosfatasa alcalina. Así mismo, al determinar la isoenzima especifica elevada podemos corroborar nuestra sospecha clínica.
Voy a mencionarte las principales causas de origen hepático que pueden ocasionar un aumento de fosfatasa alcalina: coledocolitiasis (presencia de cálculos en la vía biliar), tumor, pancreatitis crónica, quistes, divertículo duodenal, infección, colestasis (alteración en la excreción de la bilis), enfermedades metabólicas, cirrosis, hepatitis vírica, hepatitis alcohólica, etc.
De entre las principales causas de origen óseo podríamos mencionar cualquier situación que suponga una formación ósea excesiva : fracturas, tumores primarios y metastásicos, osteomielitis, enfermedad de Paget, osteomalacia, problemas hormonales, etc.
Otras causas no hepáticas ni óseas podrían ser: el li nfoma de Hodgkin, el infarto agudo de miocardio, la insuficiencia cardíaca congestiva, el infarto pulmonar , la colitis ulcerosa, la ingesta de algunos medicamentos (antigotosos, antidepresivos, antiepilépticos), etc.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Si se detecta una elevación de fosfatasa alcalina…
Ante el hallazgo de una elevación de fosfatasa alcalina normalmente se descarta en primer lugar un origen hepático por lo que se solicita una analítica completa y una ecografía hepática . Si estas pruebas no nos permiten conocer si la causa es hepática u ósea, resulta de utilidad solicitar la determinación de las isoenzimas específicas de la fosfatasa alcalina.
El aumento de fosfatasa alcalina puede acompañarse de un aumento de los niveles de otras pruebas hepáticas como bilirrubina, aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT). Si además la GGT también está aumentada, las probabilidades de que la causa sea hepática aumentan.
Los niveles de fosfatasa alcalina suelen interpretarse conjuntamente con los otros parámetros específicos del hígado. Por ejemplo, en caso de una hepatitis encontraremos la fosfatasa alcalina aumentada pero las transaminasas (AST y ALT) mucho más elevadas. Sin embargo, cuando existen obstrucciones de la vía biliar (por litiasis o piedras, por ejemplo) los aumentos de fosfatasa alcalina y de bilirrubina son muy superiores a los de las transaminasas. Ya sabes que existen otras muchas causas de elevación de fosfatasa alcalina como puede ser un cáncer de hígado.
Contrariamente, es posible que el aumento de fosfatasa alcalina sea de causa ósea en cuyo caso, muy probablemente, encontraremos el calcio y/o el fósforo alterados.
Enfermedad de Paget
Como hemos mencionado, una posible causa ósea sería la enfermedad de Paget que consiste en un trastorno metabólico que afecta a uno o varios huesos , fundamentalmente pelvis, vértebras, cráneo, fémur y tibia. Se caracteriza por un aumento inicial de destrucción ósea , seguido de un aumento de formación ósea compensatoria, dando lugar a un hueso aumentado de grosor y desorganizado, por tanto, más frágil que el sano. A pesar de que es una enfermedad asintomática en la mayoría de casos puede acompañarse de dolor óseo. Aparece generalmente a partir de los 50 años y es algo más frecuente en varones que en mujeres. Un porcentaje importante de pacientes son diagnosticados de forma casual al realizar una radiografía por otro motivo (donde se evidencia una calidad ósea alterada) o una analítica rutinaria donde se detecta la fosfatasa alcalina elevada (en este punto te quiero enfatizar, una vez más, la importancia de seguir los controles médicos rutinarios). Es interesante que sepas que una vez confirmado el diagnóstico seguimos haciendo determinaciones periódicas de fosfatasa alcalina para monitorizar la actividad de la enfermedad dado que la correlación es directa.
Como seguro habrás imaginado el tratamiento a realizar para normalizar el aumento de la fosfatasa alcalina debe ser el de la causa que origine dicho aumento (sea ósea, hepática u otra).
Por curiosidad, no lo hemos comentado antes, pero tienes que saber que también pueden observarse niveles disminuidos de fosfatasa alcalina en la analítica. En este caso pueden aparecer, por ejemplo, después de una transfusión sanguínea o de un by-pass cardíaco o por un déficit proteico. ¡Ahora ya sabemos interpretar una parte de la analítica sanguínea!
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.

Artículo especializado
Cómo Afecta la Giardiasis a los Niños y Bebés
La Giardia lamblia es el parásito más frecuentemente encontrado en Occidente. Se estima que un 6% de los adultos está infectado. En el caso de los niños, sobre todo los que acuden a guarderías, podemos hablar de entre un 20-50% de menores de tres años que son portadores del parásito. Aunque la mayoría de ellos, estarán asintomáticos (no desarrollarán síntomas de Giardiasis), pueden transmitir el parásito a otros. Esta infección es una de las principales causas de diarrea prolongada .
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
¿Qué es la Giardia?
La Giardia lamblia ( Giardia intestinalis ) fue descubierta en 1681 por Antonie van Leeuwenhoek. El descubrimiento fue de lo más casero, ya que descubrió al parásito en sus propias heces. Es un protozoo flagelado que puede presentar dos formas: trofozoít o (que vive en la superficie de la mucosa del intestino delgado, concretamente en el duodeno) y quiste (es una forma especial del parásito que le otorga resistencia y capacidad de diseminación). En el intestino, los trofozoítos se adhieren a las vellosidades intestinales y se forman los quistes que son expulsados en las heces.
Los quistes sobreviven en el agua hasta tres meses y esto provoca que, al ser ingeridos por el hombre por beber directamente el agua, en los alimentos contaminados o con el contacto de manos sucias (transmisión fecal-oral), lleguen fácilmente al intestino donde dan lugar, de nuevo, a los trofozoítos y, por lo tanto, se inicia la multiplicación y reproducción del parásito en el intestino delgado.
El parásito puede infestar también a gatos, perros, roedores y otros animales.
¿Qué es la giardiasis y cómo se transmite?
La giardiasis es una enfermedad intestinal muy frecuente, sobre todo en las áreas con poca higiene y aguas contaminadas . Aunque la infección se adquiere generalmente por tomar agua o ingerir alimentos contaminados, también puede ser transmitida de persona a persona, por una mala higiene y un incorrecto lavado de manos.
En el caso de los niños en los países donde las condiciones de salubridad del agua son correctas, el peso más importante del contagio es la transmisión interpersonal o fecal oral . Las guarderías reúnen las condiciones ideales para ello, ya que el contacto físico entre los niños es muy estrecho.
¿Qué síntomas provoca?
Los síntomas pueden ser variados, pero lo más frecuente en que tras la ingesta de los quistes y un periodo de incubación entre siete y 14 días, aparezca diarrea acuosa explosiva y maloliente. No suele acompañarse ni de moco ni de sangre. Además, el niño puede presentar poco apetito, náuseas, gases, retortijones y fiebre.
En otros casos, la diarrea suele ser diferente y se caracteriza por heces pastosas matinales o tras las comidas de color amarillento o mostaza claro.
Pueden alternarse, durante meses, episodios de diarrea intermitente y estreñimiento. Si esto se prolonga durante muchas semanas, podremos observar pérdida de peso, retraso del crecimiento, pérdida de apetito y abdomen distendido (ligeramente hinchado).
En algunos casos, el niño puede presentar reacciones alérgicas en el piel o dolor articular como consecuencia de tener el parásito en su intestino.
En el 16% de los casos se puede cronificar, ocasionando diarrea crónica que puede repercutir en la calidad de vida y en el estado de salud del niño, como veremos.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
¿Cómo se diagnostica?
La Giardia lamblia es un parásito que vive en el intestino, por lo que lo más lógico es que su diagnóstico se realice mediante un examen en fresco al microscopio de las heces . Para que el diagnóstico sea fiable y no se nos pase por alto el parásito, lo más recomendable es analizar tres muestras fecales de dos o tres días de intervalo durante un periodo no superior a 10 días. Además, también disponemos de la detección del antígeno en las heces, basado en técnicas de enzimoinmunoanálisis. Con estas dos técnicas es prácticamente imposible que se nos pase por alto una Giardiasis.
¿Cómo se trata?
El tratamiento más frecuente es metronidazol durante siete días. Siempre lo debe pautar el pediatra en función del peso del niño y tras tener la confirmación del diagnóstico.
Hasta el 50% de las Giardiasis son silentes o sin apenas síntomas. En estos casos, la infección se cura por sí sola. Pero hay que tener en cuenta que estos niños son transmisores del parásito.
¿Qué repercusión puede tener en el niño la giardiasis?
Una giardiasis crónica, de larga evolución que no se diagnostica y trata correctamente, puede tener repercusiones en el niño o bebé.
En los niños, el diagnóstico de todas la parasitosis en general, y de la giardiasis en concreto, es fundamental para evitar estas complicaciones:
Retraso del crecimiento: la diarrea crónica causa un déficit en la absorción de los nutrientes esenciales para el desarrollo y crecimiento del niño. Por lo tanto, una Giardiasis crónica puede manifestarse como escasa ganancia de peso o retraso en el crecimiento.
Síndromes de malabsorción : podemos tener síntomas de carencias de nutrientes concretos. La anemia ferropénica (o por falta de hierro) es un hallazgo habitual en la analítica.
Intolerancia a la lactosa (el azúcar de la leche): hasta un 40% de los niños que han padecido una giardiasis puede tener una intolerancia temporal a la lactosa. Esto se manifiesta con diarreas persistentes tras el tratamiento. La recomendación actual es evitar la lactosa durante el mes siguiente al tratamiento para dar tiempo a la mucosa intestinal a que se recupere y pueda llevar una dieta normal.
Prevención
La mejor estrategia para evitar la giardiasis a nivel poblacional es el control de la potabilidad del agua que se suministra en la red.
No hay ningún fármaco o vacuna eficaz para prevenirla.
En los casos de aguas sospechosas, el clorado del agua no es suficiente, ya que los quistes de giardia son resistentes.
Las medidas más efectivas son la ebullición del agua durante un minuto o añadir dos a cuatro gotas de lejía o 0,5 ml de una solución de yodo al 2% y esperar unas horas antes de tomarla.
En los alimentos, la cocción los deja libre de quistes. Para su consumo crudo, se deben lavar bien con agua y unas gotas de lejía.
El lavado de manos es fundamental para evitar el contagio de persona a persona, especialmente, en educadores y cuidadores en las guarderías.
Las normas de higiene son fundamentales y deben empezar en la familia:
Lavado de manos con agua y jabón tras ir al baño.
Lavado de manos tras cambiar pañales.
Lavado de manos antes de preparar la comida y antes de comer.
No tragar agua al nadar.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestro médico especialista en Pediatría.
Artículo especializado
¿Qué Detecta un Hemograma y Cómo Interpretarlo?
Detectar precozmente enfermedades, algunas de ellas graves, puede ser tan sencillo como realizarse hemogramas de control con frecuencia. Descubre la importancia de estos análisis.
La sangre es un tejido corporal que aparenta ser un líquido homogéneo, pero está compuesta por varios tipos celulares diferenciados, que flotan en una mezcla de agua y sustancias químicas denominada suero o plasma sanguíneo. Sirve para el transporte del oxígeno y los nutrientes a todas las células del organismo, así como otros elementos como hormonas, minerales, vitaminas…
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
¿En qué consiste?
El hemograma o hematimetría es una prueba que consiste en un recuento completo de las células sanguíneas, así como una valoración de la estructura y forma normales de éstas, a partir de una pequeña muestra de sangre. En el pasado era un proceso arduo debido a que se realizaba el recuento de forma manual, observando al microscopio, pero hoy en día los hemogramas automatizados permiten conocer con comodidad, rapidez y precisión los resultados. Una cantidad anormal de cualquiera de las células puede ser indicativo de enfermedad.
¿Cómo se realiza?
Se extrae una pequeña cantidad de sangre venosa para proceder a determinar su composición a través de un análisis de laboratorio. Generalmente, se realiza manteniendo el ayuno de al menos seis horas, puesto que la ingesta de alimentos/líquidos puede alterar mucho los resultados. Al margen de este requisito, no requiere de ninguna otra preparación especial más.
Las muestras se extraen con una jeringa o dispositivo similar (de baja presión), generalmente de venas cercanas a la flexura del codo. Primero se coloca una goma elástica atada alrededor del brazo del paciente para resaltar la vena a puncionar y así, facilitar la tarea. Cuando se ha extraído la cantidad de sangre necesaria, se retira la aguja y se ejerce un poco de presión en la zona de puntura con un algodón durante unos minutos, para evitar el manchado de sangre y la aparición de hematomas. Todo el procedimiento dura unos cinco minutos. Si sólo son necesarias unas gotitas de sangre, basta con hacer una pequeña punción con aguja en una de las yemas de los dedos y aplicar una presión suave sobre el mismo para que fluya la sangre necesaria.
Una vez obtenida la muestra, se etiqueta el recipiente en el mismo lugar con un código de barras, que contiene la información necesaria para asociarla al paciente en cuestión. Después es enviada al laboratorio en unos contenedores. El personal del área de recepción del laboratorio las clasifica dependiendo de los parámetros solicitados. A partir de ahí, los recipientes pasan a los aparatos de análisis del laboratorio para las pruebas que se requieran en cada caso.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
NO TE ALARMES SI…
Los valores no coinciden. Dependiendo del laboratorio hay ligeras variaciones en los “valores de referencia”. También pueden ser valores distintos porque se usen unidades de medición diferentes.
Hay tres tipos principales de células en la sangre:
Hematíes o eritrocitos o glóbulos rojos: son los corpúsculos celulares que transportan el oxígeno que necesitan las células de todo el organismo para respirar. En su interior contienen la hemoglobina, que lleva hierro y es lo que le otorga el color rojo a la sangre. (Valores normales (VN): 4,5-6,5 mill/mm3 en varones; 3,8-5,8 mill/mm3 en mujeres).
Cuando la concentración de hemoglobina disminuye (valores bajos en la analítica) aparecen las anemias; las más frecuentes en la población se llaman ferropénicas, porque se deben al déficit de hierro. Los valores de ferritina nos indican cuánto hierro se encuentra depositado en el organismo.
Leucocitos o glóbulos blancos : son las células de defensa frente a agentes patógenos (VN: 5000-10.000/mm3). Pueden ser:
Granulocitos o polimorfonucleares: a su vez se subdividen en neutrófilos, encargados de la defensa frente a microorganismos, eosinófilos, que combaten los parásitos y basófilos, que intervienen en las reacciones de hipersensibilidad.
Linfocitos: se encargan de fabricar anticuerpos y de la defensa contra virus y células tumorales.
Plaquetas: son las encargadas de taponar las heridas, iniciar la formación del coágulo sanguíneo e impedir la pérdida de sangre por hemorragia. (VN: 150.000-350.000/mm 3 ). Las células de nuestra sangre se generan en la médula ósea de algunos huesos, donde unas células precursoras denominadas ‘hematopoyéticas’ las van fabricando y liberando al torrente sanguíneo una vez maduradas.
Otros parámetros posibles de ser analizados en un hemograma son los siguientes:
Hematocrito: es el tanto por ciento de hematíes en el volumen total de la sangre. Es un buen indicador para valorar las anemias. Valores normales (VN): 40-54% en varones; 37-47% en mujeres).
Hemoglobina: (VN: 14-18 g/dL en varones; 12-16 g/dL en mujeres).
VCM (Volumen corpuscular medio) y H.C.M ((Hemoglobina corpuscular media): el primero es un valor que refleja el tamaño de los hematíes (VN: 83-97 fl) y el segundo refleja el promedio de la cantidad de hemoglobina que contiene cada hematíe (V.N. 27-31 pg). Ambos sirven para poner unos “apellidos” cuando se diagnostica una anemia y diferenciar así los tipos (por ejemplo, anemia microcítica hipocroma o anemia normocítica normocroma…).
CHCM (Concentración de Hemoglobina Corpuscular Media): es el índice que relaciona la cantidad de hemoglobina que lleva cada hematíe con su volumen. (VN: 32-36 g/dL).
IDH (Índice de Dispersión de los Hematíes): indica la variación en el volumen de los glóbulos rojos. Si está elevado, refleja que los hematíes no son todos del mismo tamaño (fenómeno denominado anisocitosis). (VN: 11,5-14,5 (%)).
VSG (Velocidad de Sedimentación globular): es un indicador de la velocidad con que los hematíes se agregan y sedimentan. Es un valor muy inespecífico y no significa forzosamente enfermedad, ya que aumenta con la edad, la menstruación, el embarazo, la toma de anticonceptivos…También se encuentra alterado (elevado) en patologías como infecciones, tumores, anemias, enfermedades autoinmunes, etc. (VN: 1-13 mm/h en varones; 1-20 mm/h en mujeres).
VPM (Volumen Plaquetario Medio): es un término que en medicina se utiliza como medida para conocer el tamaño medio de las plaquetas sanguíneas. (VN: 5-15 fl).
TEN EN CUENTA QUE…
La presencia en los resultados de una analítica de una o varias anomalías sanguíneas no significa necesariamente que se padezca alguna enfermedad. Un análisis de sangre es una prueba complementaria en el diagnóstico y deben realizarse otras muchas, teniendo siempre como marco de referencia la historia clínica del paciente (síntomas, circunstancias personales, antecedentes familiares y personales, etc.), para poder obtener un diagnóstico final.
¿Tienes dudas? Regístrate ahora en Savia y habla gratis con nuestros especialistas médicos por chat o videoconsulta.
Artículo especializado
Tipos de Hemorroides y Cuándo Operarlas
¿Qué son las hemorroides y por qué han tenido que pasarte justamente a ti? Para empezar, y para que no te sientas solo, te diremos que es uno de los problemas sanitarios más comunes entre las personas adultas de mediana edad.
Las hemorroides (también llamadas coloquialmente “almorranas”) son dilataciones venosas localizadas en las paredes del recto y del ano . Las principales causas que promueven su aparición son:
La dieta y las consecuencias que puede tener, como el estreñimiento crónico debido a un consumo pobre de fibra. Los esfuerzos que se producen al defecar aumentan la presión de sangre en los vasos hemorroidales, y esto puede causar la aparición de hemorroides.
Malos o inadecuados hábitos higiénicos , como puede ser permanecer demasiado tiempo sentado en la taza pues aumenta la presión en la zona llamada “cojín anal”.
El sedentarismo o la práctica de determinadas modalidades deportivas, como la equitación o el ciclismo.
Embarazo y parto : se debe a la presión del útero aumentado de tamaño sobre los vasos hemorroidales, añadido al problema frecuente de estreñimiento, causado por la relajación de los músculos pelvianos y de la pared abdominal (a su vez, provocados por acción del aumento de los niveles de la hormona progesterona) que ocurren durante este proceso fisiológico de la vida de la mujer.
Enfermedades como la hipertensión arterial, infecciones anales , abuso de laxantes irritantes, etc.
Predisposición hereditaria.
Tipos, signos y síntomas
Las hemorroides pueden ser internas (están presentes en el canal anal y no pueden verse, llegando a tamaños considerables) o externas (son las que se prolapsan -caen- a través del esfínter anal al defecar y después vuelven a su posición habitual por sí mismas o tras empujarlas uno mismo a través del ano).
Las hemorroides son a menudo asintomáticas, pero otras veces presentan diversos síntomas, que dependerán de su localización, de su tamaño o extensión, y de la presencia o no de posibles complicaciones. Los síntomas más comunes y fácilmente controlables son:
El picor o prurito anal: es el síntoma más típico y se debe a la inflamación.
Irritación o escozor anal : puede ser constante o aparecer en el momento de la defecación.
Dolor : si éste es persistente, se recomendará al paciente consultar al médico.
Hemorragia : es el sangrado que se produce durante la defecación, en forma de sangre fresca de color rojo brillante que recubre las deposiciones o en forma de gotas de sangre que manchan la taza de inodoro y/o el papel higiénico.
Otros signos/síntomas más graves serían:
Incontinencia fecal: incapacidad para cerrar el esfínter (musculatura circular) anal.
Prolapso anal o protusión hemorroidal : es la salida de las hemorroides al exterior del ano. Es frecuente tras la defecación. No suele ser dolorosa salvo complicación por infección, trombosis o estrangulamiento de la hemorroide.
Trombosis hemorroidal: se manifiesta con la aparición de dolor intenso y constante, acompañado de un bultoma (una bola) del tamaño de una uva.
¿Cómo se tratan?
Los pacientes acuden a diario a las oficinas de farmacia solicitando medicamentos para el tratamiento de las hemorroides. Es necesario realizar un cuidadoso interrogatorio por parte del farmacéutico y, ante cualquier duda o sospecha de complicación, es necesaria la remisión al médico para que valore el cuadro clínico. Debido a que es frecuente que la persona se avergüence del padecimiento de esta enfermedad, es usual la automedicación y también que se consulte a menudo primero al farmacéutico antes que al médico.
Es importante que la dispensación de productos para tratarlas esté acompañada de consejos adecuados para su buena utilización y que se eduque en la adopción de determinados hábitos higiénicos y dietéticos que pueden prevenir o paliar la aparición de hemorroides.
Medidas higiénicas
Es conveniente lavar la zona anal con agua templada o fría (con o sin jabón neutro) tras cada deposición, para evitar irritaciones. También se pueden usar toallitas húmedas especialmente destinadas a este uso, indicando limpiar con pequeños toquecitos, porque el hecho de frotar puede agravar los síntomas.
Realizar el secado de la zona anal con celulosa o algodón, evitando el papel que pueda producir irritación.
Debido a que el exceso de lavado puede provocar que desaparezca el manto graso natural de la piel de la zona tratada, es recomendable el uso de vaselina o pomadas antihemorroidales para evitar irritaciones.
Realizar baños de asiento en un bidé con agua tibia durante 10 min varias veces al día.
Medidas dietéticas
Incremento de la ingesta de alimentos ricos en fibra en la dieta, así como la ingesta de abundantes líquidos al día.
Se puede utilizar un laxante estimulante durante uno o dos días para aliviar el estreñimiento hasta que actúen las medidas anteriormente mencionadas.
Medidas farmacológicas
Existen numerosos principios activos a utilizar:
Medicamentos anestésicos locales (para calmar el dolor), como la lidocaína o la benzocaína.
Corticoides tópicos (para la inflamación), como la hidrocortisona.
Principios antipruriginosos (para calmar el picor), como el fenol o el mentol.
Medicamentos vasoconstrictores, como la efedrina.
Preparados antisépticos (para evitar la infección) como la hexetina.
Preparados emolientes (para hidratar la piel), como el “bálsamo de Perú”.
Protectores de la piel, como el óxido de zinc y el caolín.
Medidas quirúrgicas
Hay circunstancias en las que el médico aconsejará un tratamiento quirúrgico encaminado a reforzar el mecanismo de sujeción natural de los vasos hemorroidales o a extirpar el problema. Las opciones son:
Ligamento de las hemorroides : se coloca una banda elástica en la base de la hemorroide, y, al causar el cese de la circulación sanguínea en ella, ésta se seca a los pocos días y se desprende, dejando una cicatriz. Suele realizarse sin anestesia y de forma ambulatoria, aunque puede requerir varias sesiones de tratamiento.
La fotocoagulación con infrarrojos o con láser (contrariamente a la creencia popular, no son menos dolorosas), la electrocoagulación, la escleroterapia (se interrumpe el riego sanguíneo de la hemorroide mediante la inyección de una sustancia química en su base) o la criocirugía no mejoran los resultados obtenidos con la técnica anterior.
La anopexia circular mecánica : es una intervención donde se usa una grapadora o bien una sutura mecánica, recolocando y fijando las hemorroides en el interior del ano.
La hemorroidectomía: es la intervención quirúrgica consistente en la extirpación completa de las hemorroides. Es la técnica de elección en los casos de fracaso de las ligaduras, en los casos de existencia de trombosis hemorroidal o si nos hallamos ante un caso grave de hemorroides (las denominadas hemorroides de grado IV). Se realiza bajo anestesia y suele requerir una hospitalización y un período de inactividad laboral.
¿SABÍAS QUE…?
Las cremas y pomadas pueden utilizarse en las hemorroides internas y externas. Deben aplicarse por la mañana y por la noche y tras cada deposición. Si precisan aplicarse interiormente, se introducirán con la cánula que se incluye en el envase.
Los supositorios se recomiendan para las hemorroides internas. La inserción es más fácil cuando el paciente está tumbado o de cuclillas.
Las personas que no mejoren de sus síntomas en una semana, las que presenten incontinencia fecal y en las que se aprecie una protusión (abombamiento) de la hemorroide fuera del ano, se aconseja su remisión al médico especialista.
Los niños deben derivarse siempre al médico.
No es un buen consejo la automedicación. Puede existir interacción entre los medicamentos añadidos y los tratamientos ya administrados habitualmente.
Las hemorroides no producen cáncer . No existe ninguna relación entre las hemorroides y el cáncer.
Artículo especializado
El Ibuprofeno en Niños
El ibuprofeno es uno de los fármacos más populares en todas las casas: alivia el dolor, reduce la inflamación y baja la fiebre. Pero no debemos olvidar que, a pesar de su efecto casi “mágico”, en algunas ocasiones es un medicamento con más efectos secundarios de los que creemos y que debe administrarse de manera adecuada.
Un poco de historia
Su descubridor fue el farmacéutico inglés Stewart Adams en su laboratorio de Nottingham en 1961. Fue lanzado por el laboratorio Boots, tras los primeros ensayos clínicos, en 1969, como tratamiento de la artritis reumatoide. Desde 1983 está disponible en las farmacias sin necesidad de prescripción médica. Hay más de 50 presentaciones de ibuprofeno: jarabe, tabletas, crema, spray, gel, granulados y supositorios .
A pesar de que el Dr. Adams focalizó sus investigaciones en el tratamiento de enfermedades reumatológicas de tipo inflamatorio, probó su propio descubrimiento para aliviar la cefalea de un día de resaca. Suponemos que le funcionó.
Su abuso es perjudicial
A pesar de ser uno de los fármacos más baratos y resolutivos de la historia, junto con la aspirina y el paracetamol, tiene muchos detractores debido a sus muchos efectos secundarios. Su venta libre no ayuda a su uso responsable y eso provoca que se emplee de manera abusiva y descontrolada provocando, por ejemplo, daño renal en mayores de 65 años.
¿Qué es el ibuprofeno y para qué sirve?
Es un analgésico y antiinflamatorio no esteroideo (AINE), es decir, que no forma parte de la familia de los corticoides. Se utiliza para aliviar el dolor (cefalea, dolor dental, muscular y posquirúrgico). Su capacidad antiinflamatoria lo hace ideal para tratar enfermedades inflamatorias sistémicas, como la artritis reumatoide, o bien para tratar el dolor de causa inflamatoria, como el que ocasiona una amigdalitis o una otitis. Otros de sus efectos beneficiosos es ser un potente antipirético o antitérmico , es decir, con capacidad para bajar la fiebre.
¿Tiene muchos efectos secundarios en los niños?
Su venta libre no significa que sea un fármaco libre de efectos adversos. Lo que sí es cierto es que es un fármaco seguro siempre que se administre de manera correcta y a las dosis adecuadas. Es imprescindible, en los niños, consultar a su pediatra sobre qué dosis es la correcta, ya que ésta varía (y se calcula) en función del peso del niño.
En los casos de fiebre o dolor, debemos saber que el fármaco de primera línea, es decir, el que daríamos primero, si no podemos consultar al pediatra, no sería el ibuprofeno, sino el paracetamol.
Los efectos secundarios más frecuentes del ibuprofeno son:
Molestias abdominales: dolor de estómago, náuseas, vómitos y diarrea.
Mareo, fatiga o somnolencia.
Erupción cutánea.
Otros efectos más raros serían: hepatitis, alteraciones en la sangre (neutropenia o anemia) y reacciones cutáneas o del sistema nervioso.
¿Cómo se administra?
Es importante dar una dosis adecuada , en función del peso del niño y, si no tenemos acceso al pediatra, consultar bien el prospecto del fármaco. La presentación más frecuente de ibuprofeno en los niños es el jarabe , pero éste puede presentarse en diferentes concentraciones, por lo que los mililitros pueden varias de una marca a otra.
Pasos más importantes:
El niño ha de ser mayor de tres meses.
Es mejor darlo con el estómago lleno , tras las comidas, para evitar daños en la mucosa digestiva.
Hay que agitar bien el jarabe antes de administrarlo.
Verificar la fecha de vencimiento y nunca administrar un jarabe caducado.
Comprobar la concentración del jarabe, el peso del niño y la dosis adecuada.
Administrar el jarabe con el dosificado r que trae la caja. Esto te puede ayudar a calcular los mililitros exactos, ya que muchas jeringas se pueden dosificar directamente con el peso del niño.
Nunca utilices una cuchara medidora de cocina ni una taza o cuentagotas de otro producto. Las pastillas o los comprimidos masticables no se recomiendan para niños menores de seis años porque podrían presentar peligro de asfixia.
Si el niño vomita la dosis en menos de 20 minutos tras su toma, puedes volvérsela a dar.
Si te has olvidado una dosis, dásela lo antes posible pero no le dobles la dosis o le des dos para compensar. Podría ser tóxico.
Dosificación
En función de la dosis que pautemos, podemos ofrecer el ibuprofeno cada seis u ocho horas.
Recuerda que si tu pediatra no te ha calculado la dosis, debes consultar el prospecto y utilizar las jeringuillas dosificadoras del mismo jarabe.
Mantén siempre alejados y guardados bajo llave todo tipo de fármacos.
¿Qué niños no pueden tomarlo?
Niños alérgicos al ibuprofeno y a otros AINES (antiinflamatorios no esteroideos)
Bebés menores de tres meses
Si tienen antecedentes de sangrado digestivo relacionados con el ibuprofeno u otros AINES
Si presentan enfermedad inflamatoria intestinal
Si tienen problemas de coagulación
Se debe tomar con precaución y consultar siempre al pediatra si el niño presenta:
Función hepática alterada
Enfermedad renal
Asma grave
Insuficiencia cardíaca o hipertensión arterial

Artículo especializado
La Vida Después de un Infarto de Miocardio
En el día después de haber padecido un ataque al corazón es inevitable experimentar sensaciones de incertidumbre, temor e inquietud, sin saber muy bien cómo actuar en el día a día a partir de ese momento. Te explicamos qué secuelas pueden quedar y otras informaciones relacionadas con el infarto o ataque al corazón.
¿Qué es un infarto?
El infarto de miocardio (familiarmente denominado ataque al corazón) es la destrucción o muerte de parte de la capa muscular del corazón debido a la falta de oxígeno . Afortunadamente, la parte de músculo cardíaco que permanece sano después del infarto, realiza el trabajo de bombeo de sangre necesario, de tal forma que el paciente puede llevar con posterioridad una vida perfectamente normal.
SABÍAS QUE…
Las enfermedades cardiovasculares son una constante de preocupación en nuestra sociedad occidental, ya que siguen siendo una de las enfermedades más frecuentes y con mayor índice de mortalidad.
Los hombres tienen el triple de posibilidades de tener un infarto que las mujeres.
Causas del infarto
Los infartos de corazón son bastante probables cuando existe un estrechamiento de las arterias coronarias (las arterias que suministran sangre con oxígeno propiamente al corazón). Con frecuencia el estrechamiento sucede a causa de los depósitos grasos que se forman en las paredes de las arterias (fenómeno denominado arteriosclerosis) y, sobre estas placas, las plaquetas (pequeñas partículas de la sangre que participan en la coagulación) se pegan, dando lugar a un coágulo , que obstruye el paso de flujo sanguíneo.
A veces el bloqueo de paso de sangre se produce por un espasmo (estrechamiento repentino) de una de las arterias coronarias.
Factores de riesgo
Los factores que aumentan el riesgo de padecer un infarto son los siguientes:
El tabaco.
La hipertensión arterial (tensión alta).
Altos niveles de colesterol en sangre (hipercolesterolemia).
Altos niveles de azúcar en sangre (diabetes).
La edad (hombres con mayores de 45 años y mujeres de más de 55 años).
El sobrepeso y el sedentarismo (falta de ejercicio físico regular).
Antecedentes familiares de infartos de miocardio.
Signos y síntomas
Los síntomas comunes son:
Dolor aplastante en el medio del pecho , que puede irradiarse (hacerse extensivo) a cuello, mandíbula, brazos, espalda o epigastrio (zona de abdomen donde se halla el estómago, típico de los infartos de corazón que afectan al ápex o parte más inferior del músculo cardiaco). El dolor puede durar de cinco minutos a varias horas, ser constante o intermitente y el hecho de cambiar de postura o descansar no calmará el dolor.
Sensación de ahogo.
Sudoración profusa o náuseas (ganas de vomitar), vómitos.
Mareos.
Malestar general, con sensación de gravedad (“mala cara”).
A veces, se puede confundir el infarto de miocardio, propiamente dicho, con la denominada angina de pecho , porque los síntomas son parecidos. Sin embargo, a diferencia del infarto, la angina suele desaparecer a los 15-20 minutos de descansar o tomarse el medicamento.
Diagnóstico
Si hay sospecha de padecer un infarto, normalmente te llevarán al hospital y te realizarán una serie de pruebas diagnósticas.
Con un electrocardiograma (ECG ) se puede trazar la actividad eléctrica del corazón. La prueba es indolora y dura unos 5min.
Con una analítica de sangre se puede determinar si contiene “enzimas del corazón” (cuando el corazón ha sufrido daño se empiezan a filtrar a la sangre unas proteínas – enzimas- que contribuyen a regular las reacciones químicas en el organismo).
Con una Rx de tórax se puede comprobar si ha habido agrandamiento (hinchazón) del corazón.
Tratamiento
Se realizarán las siguientes intervenciones, entre otras actuaciones médicas importantes:
Generalmente se administrará al paciente una dosis de AAS (ácido acetil salicílico o aspirina).
Asimismo, los fármacos trombolíticos sirven para disolver el coágulo de sangre que obstruye la arteria coronaria, lo que permite que la sangre vuelva a fluir a la parte del corazón que sufre asfixia. Lo ideal es que se administren en el plazo de una hora desde que comenzaron los síntomas.
Si el corazón se ha detenido (paro cardiaco) el equipo médico aplicará las maniobras de reanimación cardiopulmonar (RCP), usando, entre otros elementos, un aparato denominado desfibrilador, con el que se envía un electrochoque al pecho para que el corazón vuelva a latir.
Pronóstico
Cuanto antes se aplique el tratamiento, más eficaz será, y, por tanto, mayor será la probabilidad de sobrevivir y menores las consecuencias.
Las complicaciones-secuelas derivadas de un infarto de miocardio incluyen:
Arritmias cardiacas (pulsaciones del corazón demasiado lentas o demasiado rápidas).
Hipotensión arterial peligrosa (bajada de tensión que comprometa la llegada de sangre al cerebro).
Edema pulmonar (acúmulo de líquido en los pulmones por debilidad de bombeo del corazón).
Insuficiencia cardiaca congestiva (corazón débil).
Pericarditis (inflamación del saco que envuelve el corazón).
Trombosis venosa profunda (formación de trombos en otras partes del organismo -piernas o pelvis-).
Formación de aneurismas (dilataciones de la pared del corazón sobre la cicatriz del infarto).
Rotura cardiaca .
La depresión, la pérdida de deseo sexual y el miedo a las relaciones sexuales son comunes después de un infarto.
La repetición del infarto.
Prevención
Para prevenir nuevos futuros infartos es posible que debas tomar diversos medicamentos de forma crónica: los antiplaquetarios reducen la posible “pegajosidad” de las plaquetas, los betabloqueantes disminuyen la frecuencia cardiaca del corazón y, por tanto, reducen su esfuerzo, los vasodilatadores (IECA) abren los vasos sanguíneos y, con ello, bajan la tensión arterial, lo que repercute en alivio de carga para el corazón, y las estatinas contribuyen a reducir el colesterol en sangre…
Otras medidas, no de menor importancia, son: dejar de fumar, practicar ejercicio físico regularmente adecuado a tus circunstancias, llevar a cabo una alimentación sana y equilibrada, así como reducir el consumo de alcohol, controlar las emociones y aprender técnicas de relajación, etc…
Si acudes a las revisiones médicas regulares y sigues el programa de rehabilitación reducirás considerablemente el riesgo de tener complicaciones.
RECUERDA QUE…
Has de llamar inmediatamente al 112 si sospechas que tú mismo o que otra persona está padeciendo un infarto de miocardio. No es buena idea esperar a ver cómo evolucionan los síntomas. La mayoría de los casos pueden tratarse con éxito si reciben atención médica inmediata.
Artículo especializado
Hemorragias Oculares
Un día, te miras al espejo y, sin haber notado nada raro, observas que tienes una hemorragia ocular… Seguramente te preguntarás: ¿es grave? o ¿por qué me ha pasado? Resuelve tus dudas leyendo el siguiente artículo.
Los derrames o hemorragias sanguíneas oculares pueden ser de varios tipos y afectar a distintas estructuras del ojo: a las más superficiales y, con ello, visibles a simple vista, o a las más internas (retina, vítreo), y, por tanto, visibles sólo con aparatos de oftalmología específicos. Son: el hiposfagma, el hipema, la hemorragia vítrea y la hemorragia retiniana.
Hiposfagma
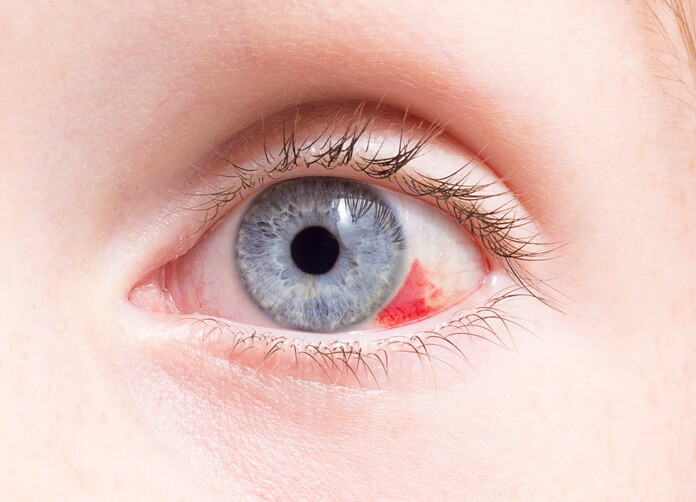
También llamado hemorragia subconjuntival , es una colección de sangre localizada en la porción anterior del ojo, por debajo de la conjuntiva (se ve sobre “el blanco del ojo”). Es una mancha roja de extensión sectorial, sin traspasar el limbo corneal (es decir, no afectará nunca a la altura de la porción coloreada del ojo o iris). Puede ser localizada o masiva (quemosis hemorrágica). Se diferencian de la simple inyección vascular en que en la hemorragia no se identifican los vasos sanguíneos.
Causas: se produce por la rotura de vasos sanguíneos de la zona, de muy pequeño calibre. Esta rotura puede ser de causa desconocida espontánea o también, generalmente si son recidivantes, puede deberse a factores desencadenantes como accesos de tos, estornudos, vómitos o cualquier otro mecanismo que produzca una maniobra de Valsalva (aumento de presión facial conteniendo la respiración), así como la toma de tratamientos farmacológicos como antiagregantes plaquetarios o anticoagulantes, traumatismos oculares (incluidos los provocados durante el parto) o crisis hipertensivas. Otras causas más raras pueden ser las discrasias sanguíneas (hemofilia, enfermedad de las células falciformes) y otras alteraciones vasculares como los tumores vasculares denominados angiomas, las púrpuras o las telangiectasias (arañas vasculares). También pueden aparecer en el contexto de algunas conjuntivitis, entre otros ejemplos.
Clínica: generalmente no provoca ningún síntoma. De color rojo intenso, indolora. Más raramente puede generar una sensación de “cuerpo extraño” en el ojo (sensación de tener “arenilla” en el ojo). Es habitual que en los momentos inmediatamente posteriores a la generación del hiposfagma, la hemorragia siga creciendo y extendiéndose, aspecto que no debe producir alarma al afectado ni a sus allegados.
Diagnóstico: se diagnostica por apreciación del sangrado a simple vista. Siempre debe ser descartada la existencia de hipertensión arterial asociada.
Tratamiento: no se dispone de tratamiento. La hemorragia se reabsorbe espontáneamente, generalmente en una o dos semanas.
Hipema
Es una colección de sangre situada en la cámara anterior del ojo (se ve sobre el iris, la parte coloreada del ojo) por debajo de la pupila.
Causas : la causa más frecuente es el traumatismo directo o contusión severa con objetos romos (p.ej. impacto de una pelota o un puñetazo sobre el ojo) o resultar de una intervención quirúrgica realizada sobre el ojo, como puede ser una intervención de cataratas. Otras causas más raras o menos frecuentes son los sangrados provocados por enfermedades que se caracterizan por alteraciones de la coagulación sanguínea, roturas o inflamaciones del iris (p.ej. por infección por virus herpes zóster) o tumores oculares como el retinoblastoma, entre otros ejemplos.
Clínica: el hipema es un sangrado de características más graves y de mayor repercusión que el hiposfagma. Sus síntomas dependen de la envergadura o magnitud del sangrado, pudiendo provocar dolor, pérdida de visión y fotofobia (hipersensibilidad a la luz). El hipema se puede complicar con la formación de un glaucoma debido a la obstrucción, por parte de la sangre derramada, de los canales de desagüe del humor acuoso ocular, provocando con ello su acúmulo y consecuente aumento agudo de la presión ocular. Ese sangrado también puede provocar, con el paso del tiempo, la tinción y opacificación de la córnea (“hematocórnea” por la impregnación de la córnea con el pigmento férrico de la sangre), dificultando su función de lente trasparente que filtra la luz. Pueden existir resangrados (se observan hasta en un 20% de los casos entre el tercer y el quinto día). Los síntomas mejoran progresivamente a medida que el sangrado se va reabsorbiendo.
Diagnóstico: Al estar situada la hemorragia en la parte anterior del ojo, puede valorarse simplemente por inspección visual del facultativo.
Tratamiento: Se debe tomar una conducta expectante, esperando a la reabsorción espontánea del sangrado. Puede ser necesaria la aplicación de colirios ciclopléjicos (atropina, para mantener dilatada de forma permanente la pupila del ojo afecto) o la administración de corticoides tópicos oculares. En ocasiones se considera oportuno incluso el ingreso hospitalario y la oclusión binocular, de ambos ojos, para impedir la movilidad ocular. También puede solucionarse el problema mediante la intervención quirúrgica para evacuar la hemorragia.
Se deberán dar consejos al paciente acerca de la necesidad de evitar esfuerzos físicos (p.ej. la práctica de ejercicio físico), promocionando el reposo y la conveniencia de mantener la cabeza elevada al acostarse (ángulo de 30-45º, para que la sangre ocupe la zona inferior de la cámara anterior y no afecte al área pupilar). Deberán realizarse controles periódicos de la presión ocular, con la finalidad de diagnosticar la evolución hacia la generación de un glaucoma lo más precozmente posible.
Pronóstico: El pronóstico empeora claramente cuando ocurre el resangrado, en cuanto a la recuperación visual y la aparición posible de glaucoma.
Hemorragia vítrea
El vítreo es una sustancia gelatinosa y transparente que ocupa 2/3 del volumen total del ojo. Está formado en el 99% de su composición por agua y limita en su parte anterior con el cristalino y posterior con la retina. La hemorragia vítrea es la presencia de sangre en la zona interna del ojo denominada cavidad vítrea . Si se produce una hemorragia en el humor vítreo, éste pierde su transparencia y la luz no puede atravesarlo, lo que ocasiona pérdida de visión en ese ojo.
Causas: La hemorragia vítrea puede ser espontánea en el contexto de diferentes enfermedades oftalmológicas y también puede tener un origen traumático (p.ej. un golpe directo sobre el globo ocular. En esta etiología estarían incluidas las intervenciones quirúrgicas). Las enfermedades oftalmológicas que característicamente predisponen a padecerla, y que suponen hasta el 95% de casos espontáneos, son: la retinopatía diabética (la más frecuente, suponiendo un total del 50% de los casos), el desprendimiento de retina regmatógeno, la retinopatía hipertensiva, el desprendimiento de vítreo posterior (en este caso el humor vítreo desprendido puede tirar de algún vaso de la retina, romperlo y causarse la hemorragia) y la obstrucción de la vena central de la retina. Otras causas menos frecuentes pueden ser: las i nflamaciones (uveítis) o los tumores oculares. En el caso concreto de la retinopatía diabética o con oclusión de vena central de la retina, la falta de oxígeno en dicha retina, estimula la formación de nuevos vasos sanguíneos anómalos y frágiles, que pueden romperse y producir sangrados.
Frecuencia: la incidencia es de alrededor de 7 casos por cada 10.000 personas a lo largo de un año, por lo que es una de las principales causas de pérdida aguda de visión.
Clínica: el síntoma principal es una pérdida brusca de agudeza visual que se desarrolla a lo largo de pocos minutos. Según la intensidad de la hemorragia, el déficit de visión puede ser completo o incompleto, con una ceguera total o parcial del ojo afectado. A veces, si el sangrado es leve, se manifiesta únicamente como la aparición de manchas que flotan (“miodesopsias” ) o visión borrosa de ese ojo. Pueden llegar a provocar glaucoma por la obstrucción, por parte de la sangre derramada, de la vía natural de desagüe del humor acuoso del ojo denominada “malla trabecular”.
Diagnóstico: es importante acudir al oftalmólogo para comprobar que no asocie ninguna complicación como un desprendimiento de retina o un glaucoma, así como para controlar su evolución. En los casos de sangrado muy extenso, se podrá realizar una ecografía ocular , para descartar el desprendimiento de retina asociado. También serán necesarios controles de presión ocular.
Tratamiento: al producirse por causas muy diversas no se puede establecer un tratamiento único para todos los casos y pacientes. El tratamiento debe ser individualizado a cada caso, en función de su causa. Si la hemorragia es leve, puede resolverse de forma espontánea, por lo que sólo requerirá tiempo de espera, pudiéndose demorar la recuperación plena de la visión incluso varios meses. En otras ocasiones, tras un tiempo de espera, si no se reabsorbe el sangrado de forma espontánea, se recomienda una intervención quirúrgica denominada “vitrectomía”, que consiste en la extracción del humor vítreo mediante cirugía mínimamente invasiva.
Pronóstico: cuando no existen causas asociadas que predispongan a la repetición de la hemorragia, la evolución suele ser buena y favorable . Sin embargo, si el origen es una retinopatía diabética, el riesgo de repetición de nuevas hemorragias es alto, la mejoría más lenta y aparecen frecuentemente complicaciones.
Hemorragias retinianas
Alteración del ojo en el que el sangrado ocurre en la fina capa retiniana , que se sitúa en la parte posterior del globo ocular, tapizando su interior. Pueden aparecer aisladas o asociadas a desprendimiento de retina o desprendimiento de vítreo posterior.
Causas : pueden ser provocadas por crisis hipertensiva s (hipertensión arterial), por una oclusión de alguna vena retiniana, por causa del padecimiento de una diabetes mellitus (la cual provoca la formación anómala de pequeños vasos sanguíneos frágiles y que pueden romperse con facilidad, secundarios a la falta de oxígeno a nivel retiniano que provoca la enfermedad). Las hemorragias retinianas pueden también producirse por violencia de zarandeo, especialmente en niños pequeños (provocándose el denominado “síndrome del bebé zarandeado-sacudido”, característico de los casos de maltrato infantil).
Clínica: Las hemorragias retinianas se describen a veces como hemorragias “en astilla”. Aquéllas que afectan a regiones periféricas de la retina pueden no dar ningún síntoma y, por tanto, pasar del todo desapercibidas durante años. Muchas veces sólo se diagnostican de forma incidental cuando el ojo se somete a una prueba oftalmoscópica de fondo de ojo por otro motivo. Otras veces, cuando la hemorragia retiniana afecta al área más central y de mayor potencial visual (mácula-fóvea) el defecto de visión puede ser importante.
Diagnóstico: Mediante la realización de un fondo de ojo. En ocasiones se administra intravenosamente un contraste fluorescente al paciente, previamente a la realización del retinograma, con la finalidad de obtener una imagen de los vasos sanguíneos de la retina más precisa.
Tratamiento: Las más leves y no asociadas a enfermedades crónicas podrán habitualmente reabsorberse solas , sin precisar intervención terapéutica. La cirugía láser es una opción de tratamiento con la que se intenta sellar los vasos sanguíneos dañados en la retina. También han sido usados tratamientos farmacológicos del tipo inhibidores del factor de crecimiento endotelial vascular (VEGF) en pacientes diabéticos.

Artículo especializado
Ejercicios Hipopresivos o Gimnasia Abdominal Hipopresiva (GAH)
Los ejercicios hipopresivos o Gimnasia Abdominal Hipopresiva (GAH) han desbancado a los abdominales tradicionales revolucionado el mundo fitness, pero ¿sabemos por qué? No es cuestión sólo de estética, se obtienen muchos beneficios para la salud, y sobre todo tienen fines terapéuticos.
¿En qué consisten?
Los ejercicios hipopresivos consisten en un sistema de tonificación enfocado en la musculatura o faja abdominal y el suelo pélvico . Se utilizan de forma terapéutica en mayor medida para tratar disfunciones de la columna y del suelo pélvico aunque también en los últimos años se ha implementado en el mundo del deporte a modo de entrenamiento para mejorar el rendimiento y prevenir lesiones.
¿Qué musculatura se trabaja con los hipopresivos?
La musculatura trabajada, el suelo pélvico y la faja abdomina l, ejerce la función de sostén de los órganos situados en la cavidad pelviana. En la vida cotidiana se producen constantes aumentos de la presión abdominal: al toser, gritar, reír, cantar, cargar pesos, mantener relaciones sexuales, practicar deporte, etc. Debido a estos y otros factores, como la inactividad, los embarazos o la menopausia estos dos grupos musculares pueden verse afectados y dejar de realizar correctamente sus funciones de sujeción.
Factores que afectan al suelo pélvico
El suelo pélvico es un conjunto de músculos, fascias y ligamentos que se localizan en la pelvis ósea comportándose como una hamaca que proporciona soporte a los órganos abdominopélvicos como la vejiga, útero y parte del intestino. Una lesión o debilidad en dicha musculatura pueden ocasionar incontinencia urinaria o fecal, prolapsos genitales o disfunciones sexuales, originadas por diferentes causas:
El embarazo ; las hormonas y el aumento del tamaño del útero durante el periodo de gestación.
El parto: provoca lesiones directas en la musculatura del suelo pélvico.
Posmenopausia: la pérdida de estrógenos hacen que la musculatura pierda su tonalidad y se vuelva flácida.
Intervenciones quirúrgicas en la cavidad pélvica.
Obesidad.
Estreñimiento.
Tos crónica.
Profesiones de riesgo (deportistas, cantantes, músicos de instrumentos de viento…).
Falta de conciencia de la zona perineal de uso en sus funciones fisiológicas.
Desequilibrio muscular ; un gran tono abdominal crea una presión intraabdominal perjudicial para el suelo pélvico.
La faja abdominal y por qué es importante trabajarla con hipopresivos
Se trata de la musculatura del abdomen que conocemos como los músculos oblicuos externo e interno y el transverso del abdomen. Este grupo muscular está ligado al suelo pélvico y además se insertan en la pelvis ósea, vertebras lumbares y costillas, revistiendo toda la parte baja de nuestro tronco, como si de una faja de tratase. De hecho, es la musculatura que proporciona la típica figura de ‘’avispa’’, pero sus funciones van más allá de la estética, como proporcionar estabilidad de la zona lumbo-pélvica , dar soporte a los órganos e intervenir en la función respiratoria. El músculo más relevante es el transverso del abdomen . Es el músculo abdominal más profundo, por lo que su activación se consigue a través de los ejercicios hipopresivos. El trabajo de este grupo muscular es primordial en pacientes que padecen de lumbalgia, ya que estas aparecen, por lo general, a causa de una inestabilidad en las vertebras lumbares. Así bien, en consulta comprobamos la efectividad de la prescripción de ejercicios hipopresivos para recuperar la tonicidad de la faja abdominal.
¿Qué beneficios aportan los ejercicios hipopresivos?
Reducen el perímetro abdominal, mejorando la postura, la función y la estética.
Influyen en la recuperación temprana durante el Postparto, previene la debilidad del suelo pélvico.
Mejoran la capacidad pulmonar y la función visceral.
Evitan la aparición de hernias (Inguinales, abdominales, crurales y vaginales)
Previenen la incontinencia urinaria, disfunciones sexuales, prolapsos…
Mejoran en el rendimiento deportivo.
Previene de lesiones articulares y musculares gracias al equilibrio del tono muscular del cuerpo.
Protege la columna lumbar gracias a la tonificación de la faja abdominal.
¿Cómo se realizan los hipopresivos?
Hay una gran variedad de ejercicios que pueden realizarse. No obstante, la clave para contraer bien la musculatura es la postura base y una correcta respiración .
Desde una postura base, sentado, de pie, estirado o en cuadrupedia se mantiene la pelvis en posición neutra y la columna elongada dirigiendo el mentón hacia el pecho. A partir de aquí, se incorporarán movimientos que deben ser coordinados con la función respiratoria. Razón por la cual será importante realizar un ejercicio previo de concienciación de la respiración , espirando y inspirando varias veces de forma relajada.
Así bien, una vez colocados en la posición y manteniendo la postura, se vacían los pulmones y realizamos una apnea mientras notamos como nuestras costillas se abren y nuestro abdomen se mete hacia dentro (respiración costodiafragmática)
Estos ejercicios son complicados de realizar por cuenta propia, por lo que es importante que se hagan bajo la supervisión de un profesional para su correcta ejecución. También es interesante efectuarlos delante de un espejo, ya que nos permitirá autocorregir la postura.
Se debe evitar hacer los ejercicios después de haber comido o antes de ir a dormir ya que estos pueden estimular la energía del cuerpo, se recomienda realizarlos por la mañana.
Contraindicaciones de los ejercicios hipopresivos
Durante el embarazo . Realizar este tipo de ejercicios durante el embarazo puede hacer que se produzcan contracciones del útero no deseadas. Por lo tanto, no se recomienda la práctica de estos ejercicios durante el periodo de gestación. También durante el postparto, se recomienda esperar 6 semanas para poder realizar estos ejercicios.
Hipertensión , puede ser un factor contraindicativo trabajar este tipo de ejercicios si se padece de hipertensión, el control de la respiración y el aumento de tensión arterial pueden ser perjudiciales. Si se cuenta con un profesional especialista se pueden realizar los ejercicios adaptados y con supervisión.
Enfermedades renales. Debido a la liberación de radicales libres durante la práctica del ejercicio que se eliminan a través de la orina y pueden suponer un sobreesfuerzo para la función de filtrado del riñón.

Artículo especializado
Funciones y Cuidados de Nuestra Flora Intestinal
La flora o microbiota intestinal se puede considerar como un órgano que se adquiere después del nacimiento, y que contribuye de manera importante en los procesos de degradación y absorción de los nutrientes de la dieta , y también cumple funciones inmunológicas y protectoras en el organismo.
¿Qué es la microbiota intestinal?
Es el nombre que recibe hoy la población de microbios que vive en nuestro intestino . Está compuesta por una gran diversidad de bacterias que cumplen múltiples funciones. Tanto su composición como sus funciones están influenciadas por factores externos como el medio ambiente y la nutrición, entre otros.
En la actualidad se sabe que la microbiota intestinal involucra una gran diversidad de especies, de hecho se dice que existen más bacterias en la flora intestinal que células en el cuerpo. Más del 95% de esta microbiota está compuesta por bacterias que mantienen una relación de simbiosis con el ser humano y pueden dividirse en cuatro familias principales: Firmicutes , Bacteroidetes , Proteobacterias y Actinobacterias .
La piel, la cavidad oral, el tracto vaginal y el tracto gastrointestinal son tejidos con las condiciones idóneas para permitir el crecimiento de estos microorganismos, pero es el tubo digestivo el que alberga casi el total de estas bacterias. La mayoría de ellas no son patógenas (no originan enfermedades) y son imprescindibles para que se realice una buena absorción de nutrientes, además de ejercer una importante barrera de defensa confiriendo integridad a la mucosa intestinal, favoreciendo la resistencia de la infección o proliferación de determinadas bacterias patógenas (parásitos y virus).
Composición de la microbiota intestinal
Sólo un tercio de la microbiota intestinal es común a la mayoría de la gente, mientras que los otros dos tercios son específicos en cada persona. Aunque cada uno de nosotros tiene una microbiota única, ésta cumple las mismas funciones fisiológicas, con un impacto directo en nuestra salud.
A pesar de que estamos en contacto permanente con microorganismos en el medio ambiente, la composición de la microbiota intestinal se mantiene estable. Sin embargo, se conoce muy poco sobre los factores que contribuyen a preservar este equilibrio, estos podrían ser los factores del propio huésped (individuo), las bacterias y el uso de antibióticos.
Existen diferencias tanto en la concentración como en el tipo de microorganismos que la componen a lo largo de todo el tracto gastrointestinal. La composición puede variar de manera temporal como consecuencia de una importante contaminación bacteriana en la dieta o debido a condiciones patológicas tales como infecciones gastrointestinales, uso de medicamentos como antibióticos y antiácidos o estados de inmunosupresión .
¿Qué funciones desempeña?
Aunque cada uno de nosotros tiene una microbiota única, ésta cumple las mismas funciones fisiológicas que se pueden dividir en tres grandes grupos: metabólicas, protectoras e inmunológicas.
Funciones metabólicas
El tracto gastrointestinal es uno de los órganos, desde el punto de vista inmunológico, más activos del cuerpo humano. La mayoría de sus funciones están moduladas por la acción de la microbiota intestinal, entre las cuales la principal es la de ahorro de energía mediante la fermentación de carbohidratos como la fibra de los vegetales y los oligosacáridos. Además, gracias al proceso de fermentación, produce ácidos grasos de cadena corta que funcionan como fuente de energía para las células.
La microbiota es también capaz de sintetizar algunas vitaminas como la B y la K.
Funciones protectoras e inmunológicas
El efecto protector de la microbiota ante agentes patógenos se divide en dos: resistencia a la colonización y estimulación del sistema inmune. En pacientes sanos, la microbiota residente evita la colonización y/o sobrecrecimiento de patógenos.
Las células epiteliales del intestino son capaces de funcionar como una barrera importante contra productos microbianos presentes en el intestino. Al mismo tiempo, permiten el paso de nutrientes, electrolitos y agua de la luz intestinal hacia el torrente sanguíneo.
La microbiota estimula la función inmune. Las interacciones entre la mucosa gastrointestinal, la microbiota y el tejido del sistema linfático son fundamentales para la defensa contra la invasión de patógenos y la infección.
La microbiota es también un factor importante en la fisiopatología de múltiples trastornos patológicos, incluyendo el síndrome de intestino irritable, el cáncer de colon y las enfermedades inflamatorias del intestino (Crohn y colitis ulcerosa).
¿Qué es la disbiosis intestinal?
Es el desequilibrio que se provoca en la microbiota, debido a una inadecuada alimentación, una dieta pobre en fibra, procesos inflamatorios, situaciones de estrés y, sobre todo, al uso de antibióticos de forma indiscriminada, que pueden eliminar la flora intestinal fisiológica.
La alimentación tiene un papel fundamental en la composición y funcionamiento de la microbiota. Es importante llevar una dieta equilibrada y variada (rica en alimentos vegetales, alimentos fermentados…) para nutrir a los miles de microorganismos que habitan nuestro intestino, y que puedan llevar a cabo las funciones antes mencionadas.
Además, añadiendo alimentos con prebióticos y probióticos también se puede mejorar la microbiota intestinal.
Los probióticos son bacterias vivas y levaduras que residen en nuestro cuerpo y que, al ser administradas en cantidades adecuadas, podrían aportar un beneficio para la salud, especialmente para la del sistema digestivo.
Éstos están destinados a mejorar la población de bacterias beneficiosas intestinales que se encuentran en el intestino, ya que promueven su desarrollo. Los mejores alimentos con probióticos son el kéfir, yogur natural, natto, tempeh, chucrut, miso, pan de masa madre, té Kombucha, kimchi… También se pueden encontrar como complementos alimenticios.
Los prebióticos son el sustrato alimenticio de los probióticos. Son un tipo de hidrato de carbono llamado oligosacáridos (se encuentran en la composición de diversas hortalizas y frutas, y en la leche materna) que nuestro intestino no puede digerir, y que favorece el crecimiento de especies beneficiosas sobre las nocivas.

Artículo especializado
Qué Sabemos de las Fobias
¿Cómo reaccionarías si te encontraras una araña en el baño, y tienes aracnofobia?, ¿y si la consulta del médico está en un séptimo piso y padeces de acrofobia? En el mundo occidental, hay tantas fobias como elementos existen en nuestro hábitat, son prácticamente infinitas y muchas veces convivimos con ellas a pesar del malestar que generan. En este artículo, veremos qué tipos de fobias existen, cuáles son sus tratamientos y qué consecuencias pueden ocasionar.
¿Qué es una fobia?
Una fobia es un trastorno de ansiedad que se caracteriza por un miedo irracional a un lugar, una situación o un objeto . Este temor extremo hace que la persona se esfuerce en evitar el peligro percibido, que siempre es mucho mayor en su mente que en la vida real y, si no puede evitarlo o no puede huir de él, sufre una angustia enorme, ansiedad o incluso un ataque de pánico al tener que enfrentarse.
Las personas con fobia a menudo se dan cuenta de que su miedo es irracional, pero paradójicamente, no pueden hacer nada al respecto para reaccionar de un modo diferente. Además, como el cerebro es capaz de reaccionar de la misma forma ante la imaginación o una foto que ante el estímulo fóbico, hay personas que con tal sólo pensarlo desencadenan una sintomatología tremendamente angustiante e inevitable.
Síntomas físicos
Sofocos o escalofríos
Sudoración
Dificultad para respirar
Temblor
Presión en el pecho
Dolor de cabeza
Mareos
Taquicardia
Náuseas
Dolor de estómago
Confusión y desorientación
Boca seca
Necesidad del ir al baño
Entumecimiento
Zumbido en los oídos
Síntomas psicológicos
Sentimiento de temor
Miedo a morir
Miedo a perder el control
Miedo a desmayarse
Fobia simple o específica
¿Qué es?
Es un tipo de fobia que se caracteriza por tener un m iedo intenso e irracional a una situación concreta, objeto, individuo o animal. Por ejemplo, miedo a conducir, a subir en un ascensor, a ver un insecto, a la sangre, a las alturas, etc.
¿Cómo se detecta?
Es difícil de detectar porque las personas que la padecen habitualmente son capaces de llevar una vida normal con tan sólo evitar el estímulo que les provoca el miedo. El peligro está en que, si no se trata, hay un alto riesgo de generalizar y que se vean afectados espacios colindantes al estímulo que provoca el temor. Por ejemplo, un miedo a las agujas puede convertirse, con el tiempo, en una fobia a los hospitales.
¿Cuál es su origen?
Se desarrollan cuando el niño tiene entre cuatro y ocho años y están vinculadas, o bien a una experiencia negativa en la niñez . Por ejemplo, si de pequeño sufriste una picadura de abeja es probable que de mayor desarrolles una fobia o pánico hacia ese insecto. La reacción de miedo que tuviste se grabó en tu mente y es por ello que, a pesar de saber, de manera racional, que lo peor que puede ocurrir es que te pique, la emoción del miedo actúa mucho más rápido. O por aprendizaje, si los adultos con los que convive el niño tienen fobias.
Fobia social
¿Qué es?
Es un tipo de fobia que se caracteriza por sentir un miedo intenso a hacer el ridículo o a lo que los otros puedan pensar de uno mismo. Por ejemplo, miedo a hablar en público, a comer junto a otra persona, a mantener una conversación de “tú a tú” por ese “qué dirán”, etc.
¿Cómo se detecta?
Las personas afectadas por este tipo de fobia, por lo general, e vitan los actos sociales y otras reuniones donde pueden ser juzgadas por los demás. Sienten que van a destacar y ser examinados por la multitud, y eso les lleva a evitar relacionarse y a llevar un estilo de vida aislado que, en muchas ocasiones, provoca que se depriman.
¿Cuál es su origen?
Se sabe que las fobias sociales empiezan a desarrollarse durante la adolescencia y que están causadas por una combinación de experiencias de la vida , la química del cerebro y la genética; aunque la mayor parte de los casos coinciden en haber sufrido una experiencia humillante anteriormente en público, que provoca que la confianza en uno mismo no logre desarrollarse.
Agorafobia
¿Qué es?
Es un tipo de fobia que se caracteriza por sentir un miedo intenso a todos los espacios abiertos , a las multitudes y, en definitiva, a los lugares donde es difícil poder escapar en el caso de tener síntomas de ansiedad o un ataque de pánico. Por ejemplo, visitar un aeropuerto, gimnasio, bar…, alejarse de casa, meterse en una tienda llena de gente, en un restaurante, etc.
¿Cómo se detecta?
Las personas afectadas por este tipo de trastorno tratan de evitar lugares abarrotados y a no salir solas a la calle, ya que la anticipación mental de estas situaciones les lleva a pensar que, si tienen síntomas de ansiedad delante de los demás, no podrán escapar o no podrán controlarlos. Les resultará muy embarazoso y aún les provocará más ansiedad.
¿Cuál es su origen?
Al igual que la fobia social, la agorafobia se empieza a formar en la etapa de la adolescencia y está relacionada con la combinación de experiencias de la vida, la química del cerebro y la genética. Las personas que la padecen coinciden en haber vivido situaciones de estrés en el momento en el que empezó a desarrollarse el trastorno y, debido a eso, un día estando fuera del hogar, sufrieron un ataque de pánico, de ansiedad, un desmayo o una asfixia, que hizo que sintieran miedo a volver a exponerse, evitando así dichas situaciones y desarrollando la agorafobia.
¿Qué tratamientos existen?
Hay diversos tratamientos para intentar curar una fobia, aunque generalmente los más eficaces son las terapias psicológicas. No obstante, en ocasiones puede llegar a ser necesaria la utilización de fármacos ansiolíticos o antidepresivos para controlar los síntomas de la ansiedad.
Tratamientos psicológicos más eficaces
Terapia de exposición : consiste en que, poco a poco, con la ayuda del psicólogo, el paciente va entrando en contacto con lo que le provoca los síntomas fóbicos con el fin de que vaya controlando sus temores de forma paulatina.
Terapia de exposición en imaginación: otra forma es que el paciente, utilizando la imaginación, recree las situaciones que teme hasta que ya no pueda controlar más sus síntomas de ansiedad, comenzando de nuevo cuando esté más tranquilo, hasta que cada vez tolere periodos más prolongados expuesto a la situación que le provoca la fobia.
Terapia de exposición mediante realidad virtual : consiste en que el paciente se va aproximando poco a poco al estímulo fóbico, inmerso en una realidad similar a la temida, pero tiene la ventaja de tener un entorno controlado que se puede modificar en función de la intensidad de malestar que experimenta el paciente y no requiere entrenamiento en imaginación, con lo cual, resulta más rápido.
Terapia cognitiva: se utiliza para ciertos tipos de fobia como es el miedo a volar. Consiste en ofrecer al paciente toda la información posible para poder afrontar el miedo; que no es tener miedo al avión sino los pensamientos catastróficos que pueden turbarnos a la hora de volar. Por tanto, se trata de cambiar los pensamientos e inquietudes negativas por conocimientos reales sobre el tema, con el fin de llegar a entender que viajar en avión es seguro.
CONSECUENCIAS DE NO TRATAR UNA FOBIA
Sintomatología cada vez más intensa.
Deterioro de las relaciones sociales, familiares y laborales.
Aislamiento social.
Disminución de la autoestima.
Inseguridad.
Frustración.
Depresión.
Sobreprotección de los hijos.
Ejemplo inadecuado para el desarrollo y formación de los hijos.
Abuso de alcohol y drogas.

Artículo especializado
Dieta en la Gastroenteritis
Muy pocos se libran de haber sufrido una o varias gastroenteritis a lo largo de su vida. Este proceso agudo, que mejora de forma espontánea al cabo de uno a tres días, aparece de repente y nos deja bien “tocados”. A pesar de lo frecuente que es, ¿sabemos por qué pasa, qué medidas tomar y qué dieta seguir durante y después de un episodio? A continuación, resolvemos ésta y otras dudas relacionadas con la gastroenteritis.
¿Qué es?
La gastroenteritis es una infección con inflamación del revestimiento interno del estómago y del intestino delgado y grueso . Es un proceso agudo que mejora de forma espontánea al cabo de uno a tres días. Esta afección provoca una alteración transitoria de la capacidad del intestino para regular la absorción y la secreción de sales y agua, así como un rechazo de alimentos, lo que produce síntomas como diarrea, vómitos, fiebre y dolor abdominal. A veces, puede prolongarse en el tiempo como consecuencia del desarrollo de una intolerancia a la lactosa o una sensibilización a las proteínas de la leche de vaca.
Generalmente es debida a una infección producida por un microorganismo (virus, bacterias o parásitos), pero también puede ser causada por la ingestión de ciertos fármacos o toxinas químicas o incluso algunas enfermedades pueden ocasionar un cuadro sintomático similar. La causa más frecuente de gastroenteritis es la de origen vírico en los países industrializados, normalmente los norovirus, o los rotavirus.
¿Quién puede padecer gastroenteritis?
La gastroenteritis vírica puede afectar a cualquier persona, aunque son los menores de cinco años y los ancianos quienes presentan mayor riesgo de padecerla. También las personas con un sistema inmunitario debilitado son más propensas a contagiarse.
¿Qué virus la provocan?
Los principales virus causantes de la gastroenteritis vírica aguda son:
Norovirus: circulan de forma habitual en la población general, especialmente durante los meses invernales, entre noviembre y abril.
Rotavirus: son la principal causa de gastroenteritis en lactantes y niños menores de dos años. Los adultos también se pueden infectar por la transmisión de los menores a los adultos.
Astrovirus : tiene una distribución mundial y transitan durante los meses fríos del año.
Adenovirus.
Torovirus y coronavirus.
¿Cómo se transmite?
Los virus que provocan la gastroenteritis vírica se transmiten de distintas maneras, pero en general lo hacen de persona a persona por la ruta fecal-oral. También a través de las siguientes situaciones:
Comiendo alimentos o ingiriendo líquidos contaminados . Sobre todo, ocurre cuando ingerimos productos crudos o poco cocidos. Por ejemplo, crustáceos y moluscos bivalvos, por contaminación fecal de las aguas en que viven. El contagio del alimento puede producirse también por un manipulador infectado.
Tocando objetos contaminados y luego llevándose las manos o los dedos a la boca o a través de superficies contaminadas, especialmente sobre las que existe contacto frecuente con las manos (barandillas, pasamanos, botones de ascensores, etc).
Mediante el contacto directo con una persona infectada. Por ejemplo, cuidando el afectado o compartiendo alimentos o cubiertos.
En lugares cerrados y concurridos como residencias de ancianos, guarderías, escuelas y cruceros, así como que provoquen brotes en restaurantes.
¿Qué síntomas tiene?
Los síntomas surgen entre cuatro y cuarenta ocho horas después del contacto con el virus y suele desaparecer por sí solo al cabo de uno y tres días, aunque puede llegar a durar hasta diez, siempre en función del tipo de virus causante. En general, pueden ser los siguientes:
Dolor abdominal.
Falta de apetito.
Pérdida de peso.
Diarrea, que puede llegar a ser líquida.
Náuseas y vómitos.
Cefalea.
Dolores musculares y articulares.
Transpiración o piel transpirada.
Fiebre, escalofríos y/o sudoración.
Cansancio.
¿Puede complicarse?
La complicación más importante de la gastroenteritis aguda suele ser la deshidratación , siendo más frecuente en los lactantes y ancianos, y en personas debilitadas por otras enfermedades.
Esta ocurre cuando la cantidad de líquido que sale del cuerpo es mayor que la que entra y puede darse cuando no se toma la cantidad suficiente de líquido o cuando se pierde más líquido corporal de lo habitual. La deshidratación puede ser lenta o rápida y eso determinara el grado de gravedad del paciente, pudiendo necesitar un ingreso hospitalario.
Los niños pequeños y los bebés tienen más probabilidades de deshidratarse porque sus cuerpos son más pequeños y tienen menores reservas de líquidos.
¿Cómo se diagnostica?
El diagnóstico de la gastroenteritis se realiza a partir de la sintomatología del paciente y, si es necesario, se efectúa un cultivo de las heces para conocer el germen causante. A menudo no es necesario recurrir a ningún tipo de medicación salvo, si es preciso, algún analgésico para tratar el dolor y/o la fiebre, o antieméticos para mejorar las náuseas y vómitos.
El papel de la dieta
Dieta líquida : el primer paso en caso de sufrir una gastroenteritis es la prevención de la deshidratación mediante una dieta líquida. Se deberán reponer sales minerales mediante la ingesta de líquidos adicionales ricos en sales y azúcar. Se puede recurrir a bebidas como: agua con limón casero, infusiones digestivas o relajantes (manzanilla, hinojo, melisa, tila, tomillo, hierbaluisa) con miel y limón, zumos de fruta sin pulpa, licuados de fruta y verdura, caldos vegetales desgrasados, soluciones de suero oral o bebidas isotónicas comerciales, opciones distintas para beber abundantes líquidos a lo largo del día. Este líquido debe ingerirse en cantidades pequeñas (de 60 a120 ml) cada 30 o 60 minutos. Con bebés o niños pequeños, puede usarse una cucharita o una jeringa.
Dieta blanca: a medida que los vómitos y/o la diarrea van cesando se iniciará una dieta blanda que incluya alimentos astringentes y sin residuos (sin fibra), con el fin de normalizar el funcionamiento intestinal.
Recomendaciones para seguir una dieta blanda
Masticar muy bien cada bocado y comer despacio para favorecer la digestión.
Realizar comidas frecuentes , pero de pequeño tamaño.
Evitar alimentos ricos en fibra : verduras, frutas, legumbres, frutos secos, frutas desecadas y cereales integrales (muesli, pan, arroz, pasta…).
Preferir la fruta cocida o al horno sin piel, en almíbar sin el jugo, o bien en forma de zumos colados no ácidos y sin endulzar.
Evitar sustancias irritantes del aparato digestivo como especias, condimentos picantes, cigarrillo, alcohol o cafeína.
Incrementar la cantidad de alimentos ricos en pectina , fibra soluble con efecto astringente: manzana rallada y oscurecida (oxidada), pera cocida, patata hervida «chafada», membrillo, boniato asado, plátano maduro…
Escoger cocciones magras y suaves como hervidos o al vapor, evitando frituras y guisos fuertes. Utilizar aceite en crudo y con moderación para no entorpeces la digestión.
ALIMENTOS ESTRELLA
Arroz y derivados: agua de cocción del arroz, preparaciones a base de arroz, sémola de arroz y similares por tener propiedades astringentes.
Sémola de trigo y derivados de la harina de trigo refinada : son ingredientes fáciles de digerir y casi no aportan fibra.
Manzana rallada y oscurecida (oxidada): por contener taninos tiene un efecto astringente y antiinflamatorio. El membrillo también es una fruta rica en taninos.
Zanahorias cocidas: son fuente de pectina o fibra soluble que favorece la adecuada formación de heces y contribuye a frenar la diarrea.
Calabaza y calabacín hervidos o al vapor : son buenas hortalizas a incluir si la diarrea empieza a ir a menos o no se produce, pues son alimentos fáciles de digerir, ricos en potasio y en agua que favorecen la hidratación.
Proteínas magras : se escogerán carnes como pollo, pescado blanco o pavo, en sus cortes más magros para facilitar la digestión.
Artículo especializado
Qué Debes Saber sobre la Gingivitis
La gingivitis es la etapa inicial de la enfermedad de las encías y, por tanto, fácil de tratar si se aborda al inicio Por eso queremos concienciarte y sensibilizarte en el cuidado gingival, por salud y también porque tanto la retracción como la inflamación gingival generan un problema estético muy importante al sonreír. Y eso ya no nos gusta, ¿verdad?
Acumulación de placa
La gingivitis es una enfermedad bucal , generalmente, por acúmulo de placa bacteriana (también llamada biofilm oral, compuesto por millones de microorganismos depositados sobre la superficie bucal). La placa se deposita constantemente sobre la superficie de los dientes y encías formando una fina película que se coloniza por bacterias. Ello da lugar a una inflamación inicial y, posteriormente, a una infección.
El depósito de placa tiene efectos a largo plazo. En fases iniciales, cuando la placa bacteriana comienza a sedimentar entre el diente y la encía tan sólo notaremos un aumento de sensibilidad por la inflamación local. Automáticamente reaccionaremos con un cepillado superficial e incompleto para evitar la sensación molesta. Un cepillado incorrecto no será efectivo y favorecerá el acúmulo sucesivo de placa en la zona. En pocas semanas se favorecerá la sobreinfección de la zona inflamada por lo que nos encontraremos con una infección en la zona. El círculo vicioso quedará establecido si no ponemos solución. Evidentemente, tanto el adulto como el niño pueden sufrir un proceso gingival.
¿Cómo sospechar de que mis encías no están sanas?
El sangrado gingival repetitivo. Es cierto que un sangrado puntual puede deberse a una mala técnica de cepillado o a un cepillo nuevo demasiado duro, pero si tus encías sangran constantemente acude al odontólogo.
También puede pasar que no sangren, Para confirmar si están sanas o no debemos descartar otros síntomas de gingivitis: color rojo brillante, hipersensibilidad, úlceras bucales, inflamación o aumento de tamaño y dolor en las encías. En cualquier caso, será el odontólogo quien determine si tus encías están sanas o no.
SI ERES FUMADOR, ¡TEN CUIDADO!
Tus encías no sangrarán con facilidad por el efecto vasoconstrictor del tabaco, pero eso no quiere decir que estén sanas. Si presentas alguno de los otros síntomas mencionados es muy probable que tengas gingivitis. Es más, el tabaco predispone a la enfermedad gingival.
Factores implicados en la aparición de gingivitis
Además del tabaco, otros factores altamente implicados en la gingivitis son: mala higiene dental, cambios hormonales (pubertad, embarazo, menopausia), enfermedades metabólicas mal controladas (sobre todo la diabetes) y efectos indeseables de algunos medicamentos de uso crónico (fenitoína, algunas píldoras anticonceptivas, etc).
Estos factores son acumulativos, es decir, si eres fumador, diabético mal controlado y no tienes un hábito higiénico correcto tienes todos los números para ser el candidato perfecto para sufrir una gingivitis.
Mención especial requiere un tipo específico de gingivitis llamada gingivitis descamativa , por tratarse de una alteración gingival no asociada a la placa.
Se caracteriza por la presencia de unas lesiones localizadas en el borde de la encía con enrojecimiento, descamación, úlceras y vesículas. Se asocia a alergia o hipersensibilidad a productos de higiene oral, mala oclusión dental o funcional y cepillado agresivo. Es muy frecuentes en personas con enfermedades autoinmunes.
Y una vez instaurada la gingivitis, ¿cuál sería la evolución natural?
La gingivitis inicial no suele dar síntomas y se presenta en forma de sangrado gingival. Cuando el proceso inflamatorio evoluciona se desencadena la enfermedad periodontal que conducirá a una periodontitis, si no intervenimos.
Una vez la enfermedad está instaurada veremos unas encías aumentadas de tamaño (por la inflamación) y separadas de la superficie dental por una pérdida de su inserción (las bacterias se filtran entre el diente y la encía formando una bolsa sobreinfectada alrededor de los dientes, llamada bolsa periodontal). Con el tiempo la encía perderá tamaño y altura y se quedará el diente expuesto dando lugar a sensibilidad con los cambios térmicos (frío y calor). La bolsa periodontal provocará afectación ósea e incluso la pérdida de hueso, dejando el diente expuesto y con movilidad. La afectación del soporte óseo implica la pérdida irreparable del diente.
No precisamos realizar pruebas complementarias para confirmar el diagnóstico de gingivitis. Con una exploración exhaustiva y una medición de la bolsa periodontal podemos conocer el grado de afectación (pudiendo ser leve, moderada o grave). Sin embargo, si la gingivitis está evolucionada se pueden tomar r adiografías de los dientes para valorar la afectación del hueso.
Una vez se diagnostica la gingivitis…
La misión del odontólogo es reducir el foco de inflamación de las encías. Para ello, se llevará a cabo, en primer lugar, una limpieza bucodental profesional (tartrectomía) para eliminar la placa y el sarro. La tartrectomía es la higiene dental llevada a cabo por el higienista dental mediante el aparato de ultrasonidos que desincrusta el material depositado en la superficie dental.
El tratamiento podrá complementarse con el uso de pasta dentífrica fluorada , hilo dental o cepillo interproximal y colutorios bucales antibacterianos como la clorhexidina.
Es importante el adiestramiento en la forma correcta de cepillado y uso de la seda dental.
Normalmente se realiza un control evolutivo en dos o cuatros semanas. Si el proceso inflamatorio persiste debe plantearse un tratamiento periodontal específico consistente en un curetaje (o raspado y alisado radicular) que se realiza bajo anestesia de cada cuadrante.
En condiciones óptimas, el sangrado y la sensibilidad de las encías deben disminuir al cabo de una o dos semanas después de este tratamiento. Si no es así, debemos seguir insistiendo en la higiene.
LOS PILARES BÁSICOS DE PREVENCIÓN Y DETENCIÓN DE LA GINGIVITIS
Higiene oral correcta: es importante disponer de un buen material (cepillo de consistencia media, hilo dental, cepillo interproximal y pasta fluorada) y de una buena técnica de cepillado. Te invito a que consultes cualquier tutorial de técnica de correcto cepillado donde se explican perfectamente los detalles de un cepillado efectivo. Respecto a la frecuencia, recomendamos, al menos, tres cepillados al día (después de las comidas) y el uso de seda dental (previo a cada cepillado). Recordarte que el cepillado dental de la noche (antes de ir a dormir) es el más importante del día
Hábito alimentario: tras la ingesta es muy importante el cepillado de arrastre de los restos acumulados durante la masticación. No demores la limpieza tras la ingesta (a los 20 minutos el pH bucal se modifica y se favorece el acúmulo de la placa). Aquí tengo que decirte que las gominolas son nuestras enemigas, pero puedes comer alguna y después cepillarte.
No fumar: no sólo tus encías te lo agradecerán.
Visitas periódicas a tu odontólogo . Si todo va bien, con una visita y una limpieza anual es suficiente. Durante el resto del año tú te encargas de cuidarte la boca.
Artículo especializado
Hemofilia en Niños
Las primeras referencias a la hemofilia se atribuyen a escritos judíos del siglo V a.C. relacionados con los sangrados graves y abundantes de niños circuncidados. Sin embargo, el reconocimiento de esta enfermedad como una entidad clínica definida no llegó hasta 1937 con los estudios de Patek y Taylor y el conocimiento de los mecanismos de coagulación, la genética y de los patrones de herencia.
La hemofilia es una enfermedad hereditaria poco frecuente causada por un defecto genético que provoca la ausencia o escasez de factores de coagulación. La hemofilia es bastante infrecuente. Aproximadamente 1 de cada 10.000 personas nace con ella.
¿Cómo se hereda la hemofilia?
Es una enfermedad de tipo hereditario, es decir, que se transmite de padres a hijos. Su transmisión está ligada al cromosoma X. Es por ello que la padecen, casi exclusivamente, los varones y, la transmite la madre. Sólo en algunos casos excepcionales, las niñas pueden nacer con hemofilia. A la madre que transmite la enfermedad se le llama portadora, ya que está sana pero tiene en su ADN el gen de la hemofilia. Las hijas, a su vez, pueden ser portadoras. Es una cuestión de estadística y de cómo se combinen los genes. Una mujer que lleve el gen de la hemofilia puede tener hijos de cuatro tipos: hijo normal, hijo hemofílico, hija portadora o hija no portadora.
Lo que nunca se produce es la transmisión de padre a hijos. Los varones hemofílicos no tienen hijos afectados, pero todas sus hijas serán portadoras. Los varones no afectados no transmiten la deficiencia ni el estado de portador.
El gen puede permanecer “escondido” y no expresarse en mujeres portadoras sanas durante varias generaciones, y aparecer después en el nacimiento de un varón afectado.
En la actualidad se puede determinar, mediante una analítica de sangre , si las hijas de una portadora son o no portadoras.
¿Cómo funciona la coagulación en una persona sin hemofilia?
Los factores de coagulación son las proteínas de la sangre que controlan el sangrado y que evitan que nos desangremos.
Cuando un vaso sanguíneo se lesiona, sus paredes se contraen para limitar el flujo de sangre al área dañada. Entonces, las plaquetas se adhieren al sitio lesionado. Al mismo tiempo, estas plaquetas liberan señales químicas para atraer a otras células y hacer que se aglutinen para formar lo que se conoce como tapón plaquetario.
En la superficie de estas plaquetas activadas muchos factores de coagulación diferentes trabajan juntos en una serie de reacciones químicas complejas (conocidas como cascada de la coagulación) para formar un coágulo de fibrina . El coágulo de fibrina es como una red para detener el sangrado.
Tipos y grados de hemofilia
La hemofilia puede tener diferentes deficiencias de factores de coagulación y, por lo tanto, la podemos dividir en tres grandes grupos:
Hemofilia A : ausencia o disminución de factor VIII.
Hemofilia B o anomalía de Christmas: ausencia o disminución de factor IX.
Von Willebrand : ausencia o disminución del factor Von Willebrand, que ocasiona un déficit de factor VIII y la reducción de la adhesión de las plaquetas a la pared vascular. Se considera una parahemofilia.
Los grados de severidad o gravedad también varían entre pacientes y depende del grado de deficiencia de los factores de coagulación. Los podemos clasificar en:
Hemofilia severa: la cantidad de factor en sangre es inferior al 1%.
Hemofilia moderada : la cantidad de factor en sangre está entre el 1 y el 5%.
Hemofilia leve: la cantidad de factor en sangre está entre el 5 y el 25%.
Manifestaciones clínicas de la hemofilia
Una de las sospechas más frecuentes es teniendo en cuenta la historia familiar. Si no hay varones afectados en la historia familiar reciente, los síntomas más frecuentes de que hay un problema de la coagulación, son la aparición de hemorragias , externas o internas, provocadas o espontáneas (sin traumatismo que las justifique).
Además de la historia clínica, familiar y de un examen físico completo, el hematólogo puede realizar varios tests de sangre , incluyendo niveles de factores de coagulación, un hemograma completo, evaluación de tiempos de sangrado, y/o pruebas genéticas.
Las hemorragias más graves son las que se producen en las articulaciones (hemartrosis), cerebro, ojos, lengua, garganta, riñones, músculos, tracto digestivo y genitales.
Podemos clasificar las hemorragias en graves o moderadas.
Hemorragias graves:
Hemorragias cerebrales tras un traumatismo craneal.
Hemorragias digestivas.
Hematomas musculares
Hemartrosis
Hematomas del suelo de la boca y laringe
Hemorragias moderadas:
Hematomas subcutáneos (debajo de la piel sin afectar al músculo).
Epistaxis (sangrados nasales).
Gingivorragia (sangrado de las encías).
Hematuria (presencia de sangre en la orina).
Su tratamiento
El tratamiento específico del niño hemofílico consiste en administrar lo que le falta o no le funciona adecuadamente, es decir, se le administra por vía intravenosa, el factor de coagulación deficitario, el VIII en caso de la hemofilia A y el IX en caso de la hemofilia B.
El tratamiento substitutivo se puede hacer de forma profiláctica (antes de que ocurra un traumatismo) o cuando se produce la hemorragia. En este último caso, es necesario aplicarlo lo más rápidamente posible. Si se administra antes de las cuatro primeras horas, la respuesta es más efectiva y rápida.
Este tratamiento sustitutivo se inicia en los primeros años de vida y consiste en la administración de varias dosis semanales de factor para mantener unos niveles mínimos superiores al 1-2% de forma permanente.
¿QUÉ SON LOS INHIBIDORES?
Algunos niños o adultos hemofílicos pueden presentar una respuesta inmunológica cuando reciben el tratamiento sustitutivo, reaccionando contra los factores de coagulación como si fueran algo extraño, atacándolos e impidiendo que éstos hagan su función. Los inhibidores no son más que anticuerpos contra los factores de coagulación administrados.
¿Cómo actuar ante una hemorragia en un niño hemofílico?
Los papás, profesores o cuidadores de un niño hemofílico deben saber que hay diferentes tipos de hemorragias en función de su gravedad.
Se debe acudir inmediatamente al hospital en el caso de que el niño presente:
Traumatismo craneal (golpe en la cabeza).
Hematemesis (vómitos con sangre).
Rectorragias (sangre en las heces).
Hemorragias de laringe (suelen aparecer raramente y casi siempre en el contexto de una amigdalitis).
En todos estos casos se debe primero administrar al niño factor de coagulación antes de ir al hospital.
En los traumatismos articulares se debe aplicar hielo y acudir al hospital para su valoración.
Las pequeñas heridas en la piel se han de lavar bien con agua y jabón , desinfectar con algún desinfectante y tapar con una tirita o una gasa estéril, haciendo presión.
Si el sangrado persiste, hay que valorar si hay que administrar factor.
Botiquín de un niño hemofílico
Se debe disponer de los recursos necesarios para solventar las algunas situaciones frecuentes:
Factor de coagulación, jeringa y agujas.
Gasas estériles.
Fármacos específicos para detener las hemorragias (recetados por su médico).
Desinfectantes (yodo o agua oxigenada).
Vendas y tiritas.
Paracetamol.
Antihistamínicos.
Corticoides.
Guantes de látex llenos de agua y alcohol al 50% y guardados en el congelador para utilizarlos en caso de traumatismo.

Artículo especializado
Dieta Aconsejada Para el Hígado Graso
La enfermedad hepática por hígado graso no alcohólico (EHGNA) o lo que comúnmente se denomina “ hígado graso ” es una patología multifactorial que debuta con acumulación excesiva de grasa en el hígado (esteatosis) en ausencia de causas secundarias como el consumo excesivo de alcohol, en cuyo caso se denominaría esteatosis hepática alcohólica.
¿Cómo se manifiesta?
Esta enfermedad se puede manifestar de dos formas:
Hígado graso no alcohólico (HGNA) o esteatosis hepática simple (cuando hay grasa en el hígado, pero ausencia de infamación).
Esteatohepatitis no alcohólica (EHNA) (cuando además de grasa en el hígado existe inflamación que puede causar fibrosis, cirrosis o cáncer de hígado).
La prevalencia de EHGNA a nivel mundial es del 20-30 % de la población y afecta al 95% de personas con obesidad , al 70% de diabéticos tipo 2 y al 50% de pacientes con dislipemia , enfermedades que, a su vez, se relacionan con la resistencia a la insulina y el síndrome metabólico. Por ello, es muy importante diagnosticar de forma precoz este trastorno y modificar sus factores de riesgo (dieta y estilos de vida) para evitar la progresión de la enfermedad, cuya consecuencia más grave es la cirrosis que puede requerir un trasplante de hígado.
¿Qué signos hacen sospechar de una enfermedad de hígado graso?
Hay ciertas personas y situaciones clínicas que pueden presentar mayor susceptibilidad para desarrollar una EHGNA. Entre los signos más destacados que nos alertan sobre una posible enfermedad de hígado graso, encontramos:
Sobrepeso u obesidad.
Resistencia a la insulina.
Aumento de las transaminasas ALT (alanina aminotransferasa) a valores entre 50-150 U/l con cifras de AST (aspartato aminotransferasa) menores que las de ALT.
Bajos valores de colesterol HDL.
Elevados valores de colesterol LDL.
Aumento de la hemoglobina glucosilada (HbA1c).
Personas con antecedentes familiares de diabetes tipo 2.
Alteraciones hepáticas en ausencia de una ingesta excesiva de alcohol (consumo diario menor de 30 g en hombres y menor de 20 g en mujeres).
¿Cómo se diagnostica la HGNA?
Debido a que muchas veces la enfermedad de hígado graso es asintomática o dichos síntomas son muy difusos (fatiga, malestar general, cansancio, pesadez, dolor e hinchazón en el lado superior derecho abdominal), es importante hacer un diagnóstico precoz a aquellas personas que puedan ser más susceptibles de desarrollarla. Los métodos diagnósticos más utilizados en estudios clínicos son:
Ecografía abdominal : es el método más empleado por ser no invasivo, ampliamente disponible y de bajo coste.
Resonancia magnética , aunque es de mayor sensibilidad que la ecografía, se utiliza en menor medida debido a su elevado coste.
Medición de la alaninoaminotransferasa (ALT) mediante analítica de sangre: se trata de una enzima hepática cuyo examen permite determinar si estamos ante una lesión hepática alcohólica o ante una HGNA.
Biopsia hepática: a través de esta prueba podemos diferenciar la esteatosis simple (HGNA) de la esteatohepatitis (EHNA) aunque sólo se recomienda realizarla en aquellos pacientes que tienen alto riesgo de tener EHGNA con fibrosis avanzada.
Tratamiento y prevención del hígado graso
La aparición de la EHGNA está muy relacionada con la resistencia insulínica , por ello, el mejor tratamiento parar tratar y prevenir esta patología consiste principalmente en medidas no farmacológicas basadas en dieta (para la disminución de peso) y ejercicio físico . Sin embargo, una vez se haya desarrollado cirrosis debido a la esteatosis hepática no alcohólica, el trasplante de hígado es una opción terapéutica, con buenos resultados.
Además, como prevención, debemos tener en cuenta que:
Ciertos fármacos pueden predisponer el desarrollo de la enfermedad: amiodarona, diltiazem, esteroides, estrógenos sintéticos, tamoxifeno y tratamiento antirretroviral.
Se debe controlar la diabetes tipo 2 con modificaciones del estilo de vida y tratamiento farmacológico si fuera necesario.
Se deben reducir los niveles de colesterol y triglicéridos . De hecho, el colesterol libre hepático tiene una mayor participación que los triglicéridos en el desarrollo de la esteatohepatitis no alcohólica (HGNA).
La cirugía bariátrica podría ser una alternativa cuando las modificaciones de estilo de vida (dieta y ejercicio) y el tratamiento farmacológico no hayan sido efectivas en personas con obesidad mórbida (IMC mayor a 40) y en ausencia de cirrosis hepática. Esta intervención podría reducir la inflamación, la esteatosis y podría incluso regresar la fibrosis hepática.
¿Cómo debe ser la alimentación para controlar el hígado graso?
Una dieta adaptada a la EHGNA no debe diferir mucho de una dieta equilibrada , aunque sí hay una serie de alimentos prohibidos o restringidos como las grasas saturadas y los azúcares simples que interfieren mucho en la regulación de la insulina. Sin embargo, también se debe priorizar el consumo de fibra y antioxidantes, componentes que tienen un efecto directo en el manejo nutricional de esta enfermedad. A continuación, nombramos las principales características alimentarias a tener en cuenta:
Si existe sobrepeso u obesidad, se debe llevar a cabo una reducción de 600-800 calorías o una restricción calórica de 25-30 kcal/kg de peso corporal ideal para lograr una pérdida de peso del 5-10% del peso inicial siempre y cuando esta reducción sea gradual (entre 0,5 y 1 Kg/semana)
La fracción de carbohidratos (arroz, pasta, patata, pan) debe ser reducida a un máximo de 45% del total de calorías, evitando el consumo de azúcares simples, presentes en el azúcar blanco o moreno, en aditivos edulcorantes (como jarabe de maíz o fructosa) y en alimentos procesados azucarados como bollería, dulces, refrescos o zumos envasados.
Cuando se consuman cereales, se debe priorizar su versión integral (pan, arroz, pasta, etc.). Además, si tomamos cereales de desayuno, debemos optar por aquellos sin azucarar (copos de avena, trigo o muesli).
Se deben consumir al menos dos raciones de vegetales al día: una ración en la comida y otra en la cena.
Se deben consumir dos o tres piezas de fruta al día. No obstante, se debe evitar la toma de zumos de fruta, aunque sean caseros, ya que en estas presentaciones se excluye la fibra, componente básico en la regulación de la resistencia a la insulina.
Se deben consumir legumbres (garbanzos, lentejas, alubias, soja) entre dos y tres veces por semana y alternar su consumo con otras proteínas magras como las carnes blancas, pescados blancos, pescado azul y huevos.
Se debe evitar el consumo de grasas saturadas (leche entera, nata, quesos grasos, embutidos) y más concretamente, evitar el consumo de grasas “trans” presentes margarinas, galletas y otros dulces ultraprocesados que contengan aceite de coco o de palma.
Se debe aumentar el consumo de ácidos grasos omega-3 presentes en pescado azul y frutos secos y utilizar el aceite de oliva virgen para aliños y cocciones.
Se deben ingerir alimentos ricos en vitamina A, C, E y selenio como, por ejemplo, pescados azules, tomate, espinacas, brócoli, pimientos, nueces y aguacate
Suprimir cualquier tipo de bebida alcohólica . El agua debe ser la bebida de prioridad.
Existen algunos estudios que sugieren que las dietas vegetarianas mejoran la resistencia a la insulina y favorecen la pérdida de peso. Por ello, se ha demostrado cierta mejora de la enfermedad de hígado graso con la sustitución de carnes y pescados por legumbres como la soja.
Y, por último. y no menos importante… la práctica de ejercicio físico mejora la insulino-resistencia y la esteatosis hepática. Por ello, se recomienda realizar una actividad cardiovascular (caminar, correr, bicicleta, nadar, etc.) durante un mínimo de 30 minutos con una frecuencia de tres a cinco veces por semana.

Artículo especializado
Hipoacusia o Cuando Falla la Audición
Todos sabemos que, con el paso del tiempo, perdemos capacidad auditiva (presbiacusia, que sería el equivalente a la presbicia de la agudeza visual). Pero, ¿cuándo se considera pérdida normal (fisiológica) o pérdida anormal (patológica)? Si tengo 40 años, ¿es normal que esté perdiendo audición (hipoacusia) o es demasiado pronto?
¿SABÍAS QUE…?
La hipoacusia es una de las pérdidas sensoriales más frecuentes y que se considera una discapacidad sensorial. Afecta alrededor del 10% de la población adulta. A partir de los 65 años casi el 50% de la población presenta presbiacusia.
Tipos de sordera
La hipoacusia implica una restricción en la relación interpersonal pues se merman sus habilidades de comunicación y ello repercute en la esfera psicológica. Según el momento en que debuta una sordera podremos clasificarla como:
Sordera prelocutiva (aparece antes de que el niño comience a hablar).
Sordera postlocutiva (aparece después de aprender a hablar).
Atendiendo a su severidad o grado de afectación hablaremos de sordera:
Leve (pérdida de 20-40 dB. La persona afecta no oirá bien en ambientes ruidosos).
Moderada (pérdida de 40-70 dB. La persona afecta no podrá seguir una conversación)
Severa (pérdida de 70-90 dB. La persona afecta sólo oye a corta distancia y sonidos de alta frecuencia).
Profunda (pérdida de 90-120 dB. La persona afecta no oye apenas).
Absoluta o cofosis (pérdida superior a 120 dB HL): pérdida total de la capacidad auditiva.
Según la localización de la lesión en la vía auditiva tendremos tres tipos de hipoacusias:
Hipoacusia neurosensorial o de percepción : por alteración en la vía de nerviosa del estímulo auditivo (cóclea, nervio auditivo o a las vías del sistema nervioso central).
Hipoacusia de conducción o de transmisión : por dificultad para la transmisión del sonido (afecta a conducto auditivo externo, membrana timpánica u oído medio).
Mixta (combinación de las dos anteriores).
¿Cómo se llega al diagnóstico de hipoacusia?
Normalmente es el paciente quién acude a visita médica indicando haber observado disminución de su audición. También es frecuente que su familiar refiera dificultad de interrelación. Para confirmar el diagnóstico es preciso realizar un interrogatorio exhaustivo , en el que debemos indagar el tiempo y la forma de evolución, la forma de inicio, si existe un posible desencadenante, si empeora en lugares ruidosos, si existe presencia de otros síntomas acompañantes, etc.
Posteriormente, realizaremos una exploración empezando por una otoscopia con la que visualizaremos el conducto auditivo y la membrana timpánica.
Para cuantificar y calificar el tipo de hipoacusia precisamos realizar unas pruebas específicas de la función auditiva. Las más frecuentemente empleadas son:
Prueba del susurro: el explorador susurra palabras que el paciente debe repetir.
Acumetría mediante el diapasón (es un artilugio metálico con forma de horquilla, utilizado para valorar la transmisión del sonido a través de la vía aérea y ósea respectivamente.
Audiometría de tonos: se realiza en un ambiente silencioso o en una cabina insonorizada. Se evalúan diferentes frecuencias. Se obtiene un registro con dos curvas para cada oído, una curva corresponde a la vía ósea y otra a la aérea. Así mismo, la audiometría nos permite cuantificar la pérdida auditiva.
Con los estudios mencionados ya podemos conocer el tipo de sordera del paciente y el grado de afectación. Es posible que para estudiar el posible origen de la sordera precisemos pruebas de imagen como la resonancia magnética (permite un mejor estudio del nervio estatoacústico y del SNC) o la tomografía computarizada (permite valorar el estado de las estructuras óseas)
¿De qué tratamientos disponemos en la actualidad?
El tratamiento dependerá de la causa, localización y gravedad de la hipoacusia. Podrían ser tratamientos médicos, quirúrgicos o audífonos convencionales .
Para la hipoacusia de percepción o neurosensorial el tratamiento de elección es la adaptación de audífonos. Están indicados en la pérdida de al menos 50 dB en las frecuencias conversacionales.
La hipoacusia de transmisión o conductiva puede tener muy diferentes causas: otitis externa o media, tapón de cerumen, perforación timpánica…Normalmente se realiza tratamiento médico o quirúrgico, según sea la causa.
Enfermedades que causan pérdida de audición
No quería dejar de hablarte de unas enfermedades con entidad propia. Estoy segura de que has oído hablar de ellas en alguna ocasión: el trauma acústico, el barotrauma y la sordera súbita. A pesar de que son motivo de abordaje individualizado tan sólo una mención de cada una de ellas:
Trauma acústico: es el que sufren los trabajadores sometidos a un ambiente ruidoso de determinada intensidad y de forma continuada. El único tratamiento eficaz es la prevención mediante protectores auditivos.
Barotrauma: es el daño físico causado por una diferencia de presión entre nuestro espacio aéreo interior y el que lo rodea. Es típico cuando un individuo pasa de un entorno de mayor presión a otro de menor presión, por ejemplo, en el caso del submarinista o del pasajero de un avión. Suele tratarse con maniobras de compensación.
Sordera súbita: se considera una urgencia médica. Suele acompañarse de acúfenos o ruidos en los oídos y, a veces, con sensación vertiginosa. La forma de presentación más característica es la pérdida brusca de audición, sobre todo al despertarse. Se acompaña casi de una fuerte sensación de presión o de ocupación en el oído. Suele tratarse con corticoides.
Para finalizar ,una pincelada de optimismo. En la actualidad se ha evolucionado a pasos agigantados respecto al diagnóstico precoz y abordaje temprano de la sordera. Es posible realizar pruebas de cribado para la detección precoz de enfermedades y prevención de minusvalías en recién nacidos. Lo recomendable es hacer el cribado entre las 12 y las 48 horas de vida, antes de salir de la maternidad. En cualquier caso, debe ser realizada en el primer mes de vida. La identificación y el tratamiento temprano de los bebés con sordera congénita (presente desde el nacimiento) facilitará el desarrollo de su lenguaje más adelante.
 Savia
Savia